Caracterización de los concentrados plaquetarios utilizados en Medicina Regenerativa
Characterization of platelet concentrates used in regenerative Medicine
Lic. Ana Iris González Iglesias, Dra Norma Fernández Delgado, MSc Mariela Forrellat Barrios, Dr. Porfirio Hernández Ramírez
Instituto de Hematología e Inmunología
RESUMEN
Actualmente las plaquetas son consideradas como una bomba o coctel de moléculas bioactivas y proteínas en proporciones fisiológicas. Los factores solubles plaquetarios han sido empleados con fines regenerativos por su acción en la reparación y regeneración de los tejidos. El Instituto de Hematología e Inmunología ha sido promotor del uso de las plaquetas con fines regenerativos. Este trabajo muestra las características de los preparados de plaquetas utilizados en la institución. Se realizó un análisis retrospectivo y comparativo entre los preparados plaquetarios empleados en la medicina regenerativa en el año 2012. Los concentrados de plaquetas se obtuvieron a partir de tromboféresis y extracción autólogas y de plaquetas alogénicas con el que se preparó el lisado plaquetario. Se calcularon las medias y las desviaciones estándar de los conteos de plaquetas obtenidos de cada preparación y se compararon mediante la t de Student para muestras independientes (p< 0.05). La concentración de eritrocitos y leucocitos se encontraron dentro de los límites habituales esperados para las reparaciones de plaquetas de acuerdo al método de obtencion. El estudio microbiológico fue negativo en todos los casos. Se obtuvo una concentración significativamente mayor en las plaquetas autólogas (p <0.001) en relación con las alogénicas. No hubo diferencias significativa entre los preparados autólogos (p=0,38) y el volumen obtenido por tromboféresis fue mayor. Se encontraron diferencias significativas en relación con el volumen de los concentrados (p<0,001). Las características de las preparaciones son similares a las de otros trabajos que emplean plaquetas naturales y de algunas comerciales. La ventaja sobre la mayoría es que el método es sencillo, rápido, económico y reproducible, no requiere del uso de activadores, es seguro y aporta un número de plaquetas capaz de liberar los factores de crecimiento necesarios para la reparación de los tejidos.
Palabras clave: factores de crecimiento plaquetarios, medicina regenerativa, lisado plaquetario.
ABSTRACT
Nowadays platelets are considered as a cocktail or a "hand grenade" of proteins and bioactive molecules in physiological proportions. Soluble platelets derived factors have been used with regenerative purposes because of their implication in tissues' repair and regeneration. Institute oh Hematology and Immunology has been promoter of the use of platelets with that purpose. This work shows the characteristics of platelet preparation used in our institution. A retrospective and comparative analysis of the preparations used in the regenerative therapy throughout 2012 was carried out. Platelets concentrates were obtained either by autologous thromboapharesis or extractions, as well as allogenic platelets with which the platelet lyses was prepared. The means and standard deviations were calculated and compared by means of Student's t-Tests for independent samples (p< 0.05). Concentration of erythrocytes and leukocytes was within the permissible limits. Microbiological tests turned out negative in all the cases. A significantly higher concentration (p< 0.001) in the autologous platelets was obtained compared to allogenic preparations. No significant differences in the autologous preparations were found (p = 0.38) and the volume obtained by trombopheresis was higher. Characteristics of these yields are similar to those obtained by other methods and reported by other. The main advantage in this case is that the method is simple, quick, economic and reproducible. It does not need for activators. It is safe and supplies a platelet number capable of releasing growth factors needed for tissue repair.
Keywords: platelets derived grow factors, regenerative therapy, and platelet lysate.
INTRODUCCION
Entre los pilares que sustentan la medicina regenerativa se encuentra la utilización de los factores solubles que intervienen en los procesos biológicos. La participación de los factores de crecimiento en la regeneración de diferentes tejidos ya fue demostrada, y las plaquetas contienen una gran cantidad de factores de crecimiento (FC), que son liberados después de su activación.1
Las plaquetas contienen múltiples proteínas que ejercen acciones sobre diferentes aspectos de la reparación tisular. Actualmente, son consideradas como una bomba o coctel de moléculas bioactivas (factores de crecimiento, citocinas, quimiocinas, incluso algunas moléculas aún no descritas) y de otras proteínas en proporciones fisiológicas. La hipótesis de que los factores solubles liberados por las células madre implantadas con fines regenerativos desempeñan una acción importante en la reparación y regeneración de los tejidos y las ventajas del uso de las plaquetas como fuente de FC, han sido señaladas en los últimos años.1-4
Hace más de 10 años, se comunicó el incremento del crecimiento de tejidos en cultivos cuando se adicionaban plaquetas. Posteriormente, se obtuvieron resultados satisfactorios con el empleo del plasma rico en plaquetas (PRP) o el lisado plaquetario (LP) en diferentes especialidades, lo que apoya el criterio de la regeneración de tejidos por los FC y el resto de los factores solubles presentes en las plaquetas, nombrados por la mayoría de los investigadores como factores de crecimiento plaquetarios (FCP)1,5,6. Hasta donde se conoce, el primer trabajo que demostró la efectividad del uso de las plaquetas en úlceras cutáneas crónicas fue publicado en 1986 y en la década de los años 90 del pasado siglo, su empleo se extendió a ortopedia y cirugía maxilofacial. 7,8
Desde hace casi una década en Cuba tiene lugar una verdadera revolución regenerativa, que ha ido desde la simplificación de los métodos tradicionales de obtención de progenitores hematopoyéticos para su aplicación en múltiples enfermedades hasta, en la etapa más reciente, la incorporación del uso de las plaquetas bien lisadas o como PRP.9
El Instituto de Hematología e Inmunología (IHI) de Cuba ha sido promotor del uso de plaquetas, tanto autólogas como alogénicas, con fines regenerativos. El presente trabajo muestra las características de los preparados de plaquetas utilizados en la institución en el período Enero a diciembre del 2012. Esto pudiera ilustrar acerca de cuál sería la concentración óptima de plaquetas para lograr la regeneración tisular efectiva y si existe alguna variación en relación con el método de obtención
MÉTODOS
Se realizó un análisis retrospectivo del volumen inicial extraído, volumen del concentrado final y cantidad de plaquetas del concentrado final de las preparaciones que se emplearon en Medicina Regenerativa en el IHI en un periodo de 1 año. Durante el período las plaquetas con este fin se utilizaron en un total de 115 pacientes, en 30 se utilizaron concentrados de plaquetas (CP) alogénicos isogrupo obtenidos a partir de PRP de donantes de sangre una vez concluido el período de vencimiento. De estos 18 fueron casos de angiología con isquemia crítica de miembros inferiores considerados por los especialistas como urgencias y 12 pacientes con drepanocitosis con úlceras en miembros inferiores que no habían respondido a los tratamientos habituales y en los que el lisado se empleó de forma tópica. En los 85 casos restantes los CP fueron autólogos, 25 obtenidos por tromboféresis y 60 por extracción de 500 mL de sangre total del paciente y posterior centrifugación para la obtención del PRP según el procedimiento habitual para este proceder. En todos los casos se empleó lisado plaquetario. El lisado se obtuvo al realizar 3 ciclos de congelación a - 30 0C y descongelación a temperatura ambiente. Posteriormente los preparados plaquetarios se conservaron congelados hasta el momento de su empleo. En los casos autólogos el volumen total obtenido se dividió en alícuotas de 10 mL para evitar la descongelación repetitiva y la posibilidad de contaminación bacteriana.
Para la evaluación del concentrado se determinaron las siguientes variables: volumen del concentrado, hemoglobina, conteo global de leucocitos (x109 /L), eritrocitos (x 1012 /L) y plaquetas (x109 /L) efectuado en contador automático de células MINDRAY BC-3200. (Bio-Medical Electronics Co. Ltd, Shenzhen, China). Se realizaron además estudios microbiológicos (Gram y Cultivos) a todas las preparaciones antes de su congelación y después de lisadas.
Las tromboféresis fueron realizadas en un equipo automatizado marca Nigale (NGL XCF 3 000) de procedencia China que fue programado para la obtención del CP en los pacientes en que el acceso venoso y las condiciones de intervención lo permitieron.
Todos los datos se incluyeron en una base de datos que se procesó con el paquete estadístico SPSS, versión 11.5. Se calcularon las medias y las desviaciones estándar de la variables cuantitativas y se compararon mediante la t de Student para muestras independientes. El nivel de significación utilizado fue p< 0.05.
RESULTADOS
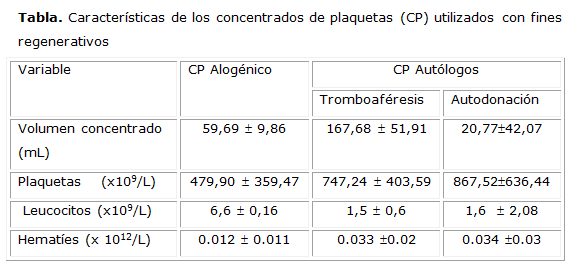
En la tabla se resumen las características de los concentrados en cuanto a volumen y concentración de plaquetas. La concentración de eritrocitos, hemoglobina y leucocitos en los CP preparados se encontraban dentro de los Aceptados para este componente. Los conteos de eritrocitos se encontraron entre 0,01 y 0,03 x 1012/L con valores de hemoglobina inferiores a 1 g/L. El conteo de leucocitos fue ligeramente superior en los CP obtenidos por donación autóloga que en los restantes grupos.
El estudio microbiológico realizado no mostró crecimiento bacteriano en ninguna muestra.
En relación con la cantidad de plaquetas, como era esperado, se apreció un mayor conteo en los concentrados obtenidos por aféresis. En relación a los obtenidos a partir de PRP autólogos y alogénicos se observó diferencias entre los conteos de plaquetas y el volumen del componente con una alta significación estadística (p <0.001).
DISCUSIÓN
El empleo de los FC en la medicina, no es un hecho reciente, incluso en los años 50 Cohen y Levi-Montalcini obtuvieron el Nobel por su trabajo con FC en tejido nervioso y posteriormente otros trabajos han mostrado el efecto de los FCP en fenómenos de reparación de tejidos. Ya desde los 90, la industria farmacéutica ha promovido el desarrollo de productos a base de factores de crecimiento derivados de plaquetas. 2,10 Sin embargo, es en los últimos años del siglo pasado y los primeros del actual, es que los FCP han tomado auge en su uso en la reparación de diferentes tejidos.10-14
Los FCP se obtienen usualmente a partir de una extracción de sangre autóloga aunque también se han obtenido a partir de plaquetas alogénicas isogrupo. La medicina regenerativa habitualmente no requiere un gran volumen de PRP y las preparaciones se realizan usualmente con la extracción de alrededor de 50 mL de sangre. 2,8
La plaquetas procedentes de los servicios de transfusiones, que mantienen la seguridad actual en la práctica pretransfusional, contienen entre 240 y 360 x 109 plaquetas suspendidas en 200 a 250 mL de plasma y se han empleado en la medicina regenerativa lo que permite el uso de plaquetas que hemostáticamente han disminuido su acción, pero que conservan su capacidad de secretar FCP y otros materiales bioactivos. Esto posibilita aprovechar un producto hasta hoy desechado.5,15 Si las plaquetas son obtenidas por aféresis, contienen entre 200 y 400 x 109 plaquetas en 200 a 300 mL de plasma de un solo donante.
Lo recomendado para índices de calidad es que estos preparados deben contener una cantidad de eritrocitos inferior a 3 x 109 y de leucocitos menor de 1 x 109.16 Los concentrados obtenidos en este trabajo concuerdan con estos parámetros.
La disponibilidad de un método sencillo, rápido y económico en la obtención del PRP es importante para resolver muchas de las afecciones que pudieran beneficiarse con estos procederes. En este trabajo se empleó el lisado plaquetario por varias razones:
1) permitía conservar por un periodo más largo de tiempo el componente extraído, por lo que una sola extracción se podían obtener varias aplicaciones,
2) se podían usar los componentes plaquetarios utilizados en banco de sangre,
3) el uso de los componentes plaquetarios convencionales permite su empleo en situaciones de urgencia y en pacientes con dificultades en el acceso venoso.
Al analizar los resultados de los concentrados de plaquetas que fueron empleados en este trabajo vemos que el volumen final (VF) estuvo en relación con el volumen inicial de extracción, siendo el volumen final de las plaquetas obtenidas por tromboféresis el mayor, ya que en esos casos se obtiene solo la capa plaquetaria. Sin embargo este método encarece el proceder, por la necesidad de tener disponible el equipamiento, los equipos de extracción y el personal calificado para la realización de la aféresis. Por esta razón y teniendo en cuenta que la concentración de plaquetas es similar en ambos métodos autólogos, no resulta imprescindible la obtención de plaquetas por aféresis.
El VF del concentrado en mililitros en las plaquetas autólogas obtenidas por una autodonación habitual depende fundamentalmente del volumen inicial (VI) extraído y es similar al publicado con los sistemas AGPÒ, comercializado por MBA (VI 400 mL para 20 mL de VF), GPS de Biomet-Merck (VI 27-110 mL para 3-12 mL de VF), SmartPrep de Harvest Technologies Plymount, MA ( VI 20-120 mL para 3-20 mL de VF). 17,18 y el sistema PGRF comercializado por BTI System a partir de las investigaciones de Anitua y colaboradores (VI 9 - 42 mL para 4-32 mL de VF). 19
En cuanto a la cantidad de plaquetas del concentrado, la cantidad significativamente superior obtenida en las plaquetas autólogas obtenidas por donación convencional puede explicarse porque las plaquetas alogénicas son empleadas en la terapia celular después de 5 o más días de su extracción, cuando han perdido su valor hemostático y esto hace que la cantidad inicial pueda descender con los días y al mismo tiempo están más diluidas en la fracción plasmática
Por otra parte las plaquetas obtenidas por aféresis contienen una concentración superior a las obtenidas por el método habitual en los bancos de sangre y la similitud del contenido plaquetario con las obtenidas de una extracción autóloga común, está dada por la utilización en este caso de la porción de PRP donde el número de estas es hasta 8 veces superior al que fisiológicamente se encuentra en la sangre de un individuo normal.
Los resultados en las concentraciones de plaquetas de acuerdo al volumen del concentrado son similares a las referidas en los productos comerciales anteriormente señalados.
Se ha planteado que un PRP tiene entre 2-3 y 5-6 veces el número de plaquetas presentes en la sangre circulante. Otros autores han publicado cifras promedio de 5.5 veces.14 En general se acepta que concentraciones de 1 x106 plaquetas/L tienen un efecto óptimo para asegurar una cantidad de FCP suficientes para la regeneración de los diferentes tejidos y que cantidades superiores a 1,8 x106/L pueden tener un efecto inhibitorio en la regeneración.8, 13,17
Los valores de leucocitos ligeramente superiores en las plaquetas autólogas obtenidas mediante la donación habitual, se explican porque al seleccionar de forma manual la capa inferior del contenido plasmático que es la conocida como PRP y que está inmediatamente encima de la capa leucocitaria pudiera existir contaminación con leucocitos. No obstante los valores obtenidos están dentro de los recomendados para esta preparación
Las características de las preparaciones analizadas en este trabajo son similares a las de otros trabajos que emplean plaquetas naturales y a las de algunas preparaciones comerciales existentes. La ventaja sobre la mayoría de estas últimas es que este es un método sencillo, rápido, económico y reproducible, que no requiere del uso de activadores y que es seguro ya que aporta un número de plaquetas capaz de liberar los FCP necesarios para la reparación de los tejidos y no contiene microorganismos. Además el contenido de eritrocitos esta en los parámetros recomendados para su calidad.
Aunque se ha planteado que la concentración de FCP no tiene una relación directa con la cantidad de plaquetas del concentrado, sería necesario completar este estudio comparando la efectividad con el número de plaquetas infundidas en los pacientes tratados.
REFERENCIAS BIBLIOGRÁFICAS
1. Fernández-Delgado N, Hernández-Ramírez P, Forrellat-Barrios M. Espectro funcional de las plaquetas:de la hemostasia a la Medicina Regenerativa. Rev Cubana Hematol Inmunol Hemoter. 2012 [citado: 29 de junio de 2013]; 28 (3). Disponible en: http://www.bvs.sld.cu/revistas/hih/vol28_3_12/hih02312.htm
2. Montón-Echeverría J, Pérez-Redondo S, GómezBajo GJ. Experiencia clínica en el empleo defactores de crecimientos autólogos obtenidos de plasma rico en plaquetas. Cir Plast Iberolatinoam. 2007;33 (3):155-61.
3. Hernández Ramírez P. Medicina regenerativa y células madre. Mecanismos de acción de las células madre. Rev Cubana Hematol Inmunol Hemoter. [serie en Internet]. 2009 Abr [ 23 de junio de 2013];25(1): Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0864-02892009000100002&lng=es&nrm=iso&tlng=es
4. Parazzi V, Lazzari L, Rebulla P. Platelet gel from cord blood: a novel tool for tissue engineering. Platelets. 2010: 21(7):549-54.
5. Balbo R, Avento I, Marenchino D, Maddalena L, Menardi G, Peano G. Platelet gel for the treatment of traumatic loss of finger substance. Blood Transfs 2010;(4): 255-9.
6. Eppley BL, Pietrzak WS, Blanton M. Platelet _rich plasma: a review of biology and applications in plastic surgery. Plast Reconstr Surg 2006; 118(6):147e-59e.
7. Knigton D. Ciresi KF, Fiegel VD, Austin LL, Buttler EL. Classification and treatment of chronic nonhealing wound. Successful treatment with autologous platelet-derived wound healing factors (PDWHF) Ann Surg 1986; Sep 204(3):322-30.
8. Carrasco J, Bonete D, Gomar F. Plasma rico en plaquetas vs. Plasma rico en factores de crecimiento. Rev. Esp. de Cirug. Ost. 2009; 239(46):127-40.
9. Hernandez- Ramirez P. Medicina Regenerativa y aplicaciones de las células madres: una nueva revolución en medicina.Rev.Cubana de Medicina. 2011; 50(4):338-40.
10. Gámez-Pérez A, Arteaga-Báez J, Rodríguez-Orta C, Saavedra-Martínez N, González-Cordero F, Sanabria-Negrín J, et. al. Aplicación local del lisado plaquetario en úlceras postflebíticas.. Revista Cubana de Hematología, Inmunología y Hemoterapia [revista en Internet]. 2012 [citado 2013 Mar 28]; 28(4):[aprox. 0 p.]. Disponible en: http://www.revhematologia.sld.cu/index.php/hih/article/view/11
11. Alfonso-Valdés A, Feísto-Castex T, Llopiz-Casanova L, Hernández-Ramírez P. Calidad de vida en pacientes con isquemia crónica de miembros inferiores tratados con células madre adultas. Revista Cubana de Hematología, Inmunología y Hemoterapia [revista en Internet]. 2012 [citado 2013 Mar 28]; 28(4):[aprox. 0 p.]. Disponible en: http://www.revhematologia.sld.cu/index.php/hih/article/view/12
12. Mishra A, Woodall J Jr, Vieira A. Treatment of tendon and muscle using platelet-rich plasma. Clin SportsMed. 2009;28(1):113-25.
13. Lacci K M, Dardik A, .Platelet-Rich Plasma: Support for Its Use in Wound Healing. Yale J Biol Med 2010;(83):1-9.
14. Greppi N, Mazzucco L, Galetti G, Bona F, Petrillo E, Smacchia C et al. Treatment of recalcitrant ulcers with allogenic platelet gel from pooled platelets in age hypomobile patient. Biologicals 2011; 39:73-80
15. Platelets Concentartes. Transfus Med Hemother. 2009; 368: 372-82. PMID: 21245968.
16. Lopez-Vidriero E, Simon,D A, Sanchez M, Johnson D H, The Use of Platelet-Rich Plasma in Arthroscopy and Sports Medicine: Optimizing the Healing Environment. Journal of Arthroscopic and Related Surgery. 2010;26(2):269-78.
17. López-Oliva F, Vicario-Espinosa C, Almoguera Villacañas JR. Plasma Rico en plaquetas, Análisis comparativo de cuatro presentaciones comerciales. Patología del aparato locomotor. 2003; 1(1):59-66.
18. Anitua E, Sánchez M, Orive G, Andia I. The potential impact of the preparation rich in growth factors (PRGF) in different medical fields. Biomaterials 2007;28:4551-60.
Recibido: 16 de septiembre de 2013.
Aprobado: 23 de octubre de 2013.
CORRESPONDENCIA A:
Lic. Ana Iris González Iglesias. INSTITUTO DE HEMATOLOGÍA E INMUNOLOGÍA. Apartado 8070, La Habana, CP 10800, CUBA.
Tel (537) 643 8695, 8268. Fax (537) 644 2334. Email: rchematologia@infomed.sld.cu