ARTÍCULO ORIGINAL
Aislamiento y caracterización de células mesenquimales derivadas de tejido adiposo
Isolation and characterization of mesenchymal cells from adipose tissue
José Armando GalvánCabrera1, Alex Miranda Rodríguez2, Joel de León Delgado2, Consuelo Macías Abraham1, AymaraBaganet Cobas1, Teresa Rondón Corrales2, Ana Iris González Iglesias1, Berta B Socarras Ferrer1, Antonio Bencomo Hernández1, René A Rivero Jiménez1, Porfirio Hernández Ramírez1
1 Instituto
de Hematología e Inmunología, La Habana, Cuba.
2
Centro de Inmunología Molecular, La Habana, Cuba.
RESUMEN
Introducción
: Existe un creciente interés científico en el potencial terapéutico
de las células madre mesenquimales derivadas de tejido adiposo ( ADSCs,
en inglés). Estas células son abundantes en el tejido adiposo, son
de fácil obtención y con un alto potencial de diferenciación
hacia linajes celulares especializados incluyendo adipocitos, osteocitos, condrocitos,
miocitos, cardiomiocitos, tenocitos, vasos sanguíneos y neuronas. Este
trabajo se desarrolló con el objetivo de implementar en el laboratorio
un procedimiento para aislar y cultivar ADSCs, con características que
corresponden a las informadas para este linaje celular.
Método: los precursores de células adiposas humanas se obtuvieron
de tejido subcutáneo abdominal. Las células se separaron enzimáticamente
del tejido y se decantaron por centrifugación, luego de cultivadas, se
caracterizaron en su capacidad de diferenciación y por su marcadores fenotípicos.
Resultados: Las ADSCs aisladas se replicaron en estas condiciones de
cultivo y mantuvieron un fenotipo estable durante todo el período de estudio.
Se comprobó su potencial adipogénico y osteogénico in vitro,
como corresponde a las células madre mesenquimales. El estudio por
citometría de flujo mostró que estas células expresanCD73, CD90
y CD105 y son negativas para los marcadores de linaje hematopoyético CD34
y CD45.En los ensayos de inhibición in vitro, las ADSCs demostraron
su capacidad para inhibir la proliferación de células T humanas.
Conclusiones : La caracterización fenotípica y funcional de
las ADSCs obtenidas a partir del tejido adiposo abdominal demuestra que es posible
la obtención mediante cultivo in vitro de células mesenquimales
humanas sin inducir diferenciación espontánea, manteniendo su integridad
funcional y altos niveles de proliferación, lo que sienta las bases para
el inicio de ensayos preclínicos y su uso futuro en la terapia celular
en nuestro país.
Palabras clave: células madre, células mesenquimales, tejido adiposo, terapia cellular.
ABSTRACT
Introduction
: There is growing scientific interest in the therapeutic potential of stem
cells derived from adipose tissue (ADSCs). These cells are abundant in adipose
tissue, are readily available and have a high potential fordifferentiation into
specialized cell lineages including adipocytes, osteocytes, chondrocytes, myocytes,
cardiomyocytes, tenocyte, endothelial cells and neurons. The aim of this work
was to isolate, cultivate andcharacterize ADSCs.
Methods : human adipose precursor cells were obtained from abdominal
subcutaneous tissue. Cells were enzymatically separated from the tissue and
decanted by centrifugation, cultured and finally analyzed.
Results : The ADSCs were able to replicate in our culture conditions.
The cells maintained their phenotype in different passages throughout the study
period, confirming its feasibility for in vitro culture. Also the ADSCs were
induced to adipogenic and osteogenic differentiation, verifying its potential
as mesenchymal stem cells in vitro. The flow cytometric study showed that these
cells expressed CD73, CD90 and CD105 (markers of mesenchymal cells) and they
were negative for CD34 and CD45 (hematopoieticcell markers). The ADSCs were
able to inhibit in vitro the proliferation of T cells.
Conclusions : It is possible to obtain ADSCs by in vitro cultivation
without adipogenic induction, maintaining its functional integrity and high
proliferation; this cell could be an important tool for the cellular therapy
in our country.
Keywords: stem cells, mesenchymal cells, adipose tissue, cellular therapy.
INTRODUCCIÓN
Las células madre se caracterizan por su habilidad de renovación y su potencial de diferenciación y pueden ser clasificadas en dos grandes grupos: las embrionarias y las adultas. En el caso de las embrionarias, que se derivan de las células del blastocisto, tienen el potencial de diferenciarse en todas las líneas celulares generando así un organismo, por lo que se denominan totipotenciales. En el caso de las células madre adultas, son poblaciones celulares que se encuentran en los órganos de animales adultos en baja frecuencia y no tienen el potencial de formar un organismo completo, pero se pueden diferenciar en líneas celulares específicas. Las células madre mesenquimales (MSC) pertenecen a este grupo 1.
Las MSC poseen mucho potencial en la aplicación clínica por su capacidad de expansión in vitro e in vivo y de diferenciarse en varias líneas celulares, incluyendo osteocitos, condrocitos, miocitos, cardiomiocitos, adipocitos, tenocitos, vasos sanguíneos y neuronas 2-10.
La ingeniería tisular ofrece una opción prometedora para la reparación o regeneración de tejidos dañados o enfermos. No obstante, la fuente o el protocolo de extracción y cultivo ideal para obtener este tipo de células no se ha definido aún. Algunas de las propiedades que hacen que las MSC adultas sean bien vistas en la medicina regenerativa son: facilidad de recolección, tasas de proliferación altas en expansiones ex vivo y capacidad de diferenciación multilinear4.
El tejido adiposo se deriva del mesodermo y contiene una población microvascular de células endoteliales, músculo liso y células madre. Estas pueden ser enzimáticamente extraídas del tejido adiposo y separadas de los adipocitos por centrifugación y filtración. Una vez realizado este procedimiento una población más homogénea emerge en condiciones de cultivo celular. Esta población (llamada células madre derivadas de tejido adiposo, ADSC siglas en inglés) comparte muchas características de su contraparte en médula ósea (llamada células madre derivadas de la médula ósea, BM-MSC, siglas en inglés), incluyendo su potencial proliferativo y su habilidad de diferenciación multilinear4, 9-12.
Se ha determinado que existe una concentración de hasta 40 veces más de células madre en una muestra de grasa que en una de médula ósea, lo que le da ventajas para su aislamiento y manipulación a gran escala 4, 12. Además, muestran una caracterización muy similar a las derivadas de médula ósea, siendo positivas para la expresión de CD29, CD44, CD71, CD90, CD13, CD105, SH-3 y STRO-1, pero también algunos marcadores específicos como CD49d, CD106, CD54 y CD3413. No se han observado diferencias significativas entre los dos tipos de células respecto a la adherencia estromal, el crecimiento, la senescencia celular, la capacidad de diferenciarse en diferentes líneas celulares y la eficiencia de la transducción genética14.
Por otra parte, la supresión inmune y propiedades antinflamatorias de las MSC están muy bien establecidas y abarcan claramente potentes influencias moduladoras sobre la generación y establecimiento de enfermedades asociadas amúltiples fenotipos de células T efectoras 15, 16. Las MSC utilizan una variedad de diferentes factores solubles secretados por ellas con el fin de suprimir las respuestas inmunes. Algunos de estos factores los producen constitutivamente, tales como la molécula HLA-G5 17, 18, la prostaglandina E2 (PGE2)19 y galectinas20. Los efectos inmunomoduladores ejercidas por las MSC se pueden aumentar si las células son activadas por citoquinas tales como el IFN-γ16. También se ha demostrado que las MSC pueden ser activadas por la estimulación de sus receptores de tipo Toll 21. Los modelos preclínicos proporcionan un fuerte impulso en una mejor comprensión de la terapia con MSC para la generalización de uso en el tratamiento de una gama de enfermedades autoinmunes mediadas por células T comunes y para la prevención o tratamiento de las complicaciones de los trasplantes, tales como el rechazo y la enfermedad de injerto contra huésped (EICH) 22-25.
Hay una gran cantidad de literatura que define protocolos de cultivo para las ADSC4, 5, 9, 10, 12, 26, 27. El proceso de obtención se inicia con una liposucción al paciente que se realiza bajo anestesia local o sedación o mediante su toma durante una cirugía de abdominoplastia. El tejido se somete a un proceso de laboratorio mediante el cual se aíslan las células adecuadas; que se cultivan a 37ºC hasta que el crecimiento alcanza la subconfluencia. En ese momento pueden emplearse terapéuticamente o ser criopreservadas para su uso posterior. Este método presenta ventajas respecto al de obtención de células de médula ósea: es seguro, la grasa es un tejido de fácil acceso, es menos molesto y agresivo que las punciones medulares, puede realizarse bajo anestesia local, las células se pueden criopreservar 26.
Por todo lo anterior, se implementó un procedimiento para aislar, cultivar y caracterizar ADSC para su posible uso en la prevención y tratamiento de la EICH, complicación del trasplante hematopoyético; en el tratamiento de enfermedades autoinmunes y en la medicina regenerativa.
MÉTODOS
Origen delas células mesenquimales derivadas de tejido adiposo
Las muestras de tejido adiposo se obtuvieron durante el acto quirúrgico de tres mujeres con antecedentes de salud que fueron sometidas a abdominoplastias asociadas a hernias umbilicales en el servicio de cirugía del Hospital General Docente "Enrique Cabrera". Para ello se tomaron entre 30 y 50 g de grasa de la zona de la herida quirúrgica. Este estudio fue aprobado por el Comité de Ética de la Investigación s del Instituto de Hematología e Inmunología (IHI), La Habana, Cuba y todos los donantes firmaron un consentimiento informado escrito.
Las muestras obtenidas se colocaron en un recipiente con una solución isotónica estéril. Una vez empacada la grasa, se mantuvo en frío por no más de 24 horas antes de comenzar su procesamiento en el laboratorio.
Aislamiento de las células mesenquimales derivadas de tejido adiposo
El aislamiento de las células se realizó de acuerdo al método descrito por Bunnell y cols.27 con algunas modificaciones. Las muestras de tejido adiposo, contenidas el medio de transporte, se manipularon dentro de un ambiente controlado en una cámara de flujo laminar. En estas condiciones se extrajeron las muestras de tejido y se fragmentaron en pequeños trozos para facilitar la acción de la colagenasa en la separación celular. Para ello se preparó una solución de colagenasa tipo 3 al 0,3 % (Sigma Aldrich, EUA) en solución salina tamponada con fosfato (SSTF), 1 % de penicilina / estreptomicina (P/E) (Gibco, EUA), la que se filtró por 0.2 µm (Sartorius, EUA) y se agregó al tejido adiposo durante 1h a 37°C en agitación. El material digerido se filtró a través de una maya de nylon de 150 µm. Se procedió a neutralizar la enzima con igual volumen de medio suplementado con 20 % de suero fetal bobino (SFB, Gibco, EUA) y se realizó centrifugación a 1200 rpm durante 10 min. Se descartó el sobrenadante, se resuspendió el precipitado en SSTF con P/E 1% y se procedió a otra centrifugación. Se descartó el sobrenadante y resuspendió el precipitado en 2 mL de medio suplementado con SFB al 20 %, se determinó el número y viabilidad de las células.
Cultivo y expansión
Las células se sembraron siempre en una densidad de 2x104/cm2en un medio estándar compuesto por Dulbecco's Modified Eagle's Medium Ham (DMEM, Gibco, EUA) suplementado con 20 % de SFB, 100 U/mL penicilina y 0,1 mg/mL de estreptomicina. El cultivo se mantuvo a 37°C en atmosfera húmeda al 5 % de CO2. Las células se cultivaron durante 7 pases hasta la subconfluencia, en frascos de cultivo durante 7-10 días.A partir del segundo pase el SFB se utilizó al 10 %. Cuando las células adheridas al plástico alcanzaron una confluencia de aproximadamente el 80%se trataron contripsina al 0,25 % (Gibco, EUA) durante 3 min, a 37°C. La solución de tripsina se neutralizó con igual volumen de medio DMEM completo. La suspensión de células se centrifugó a 300 g durante 10 min y el sobrenadante se descartó. El precipitado se resuspendió en medio DMEM completo y las células se contaron en un hemocitómetro usando azul de tripán.
Diferenciación a adipocitos y osteocitos
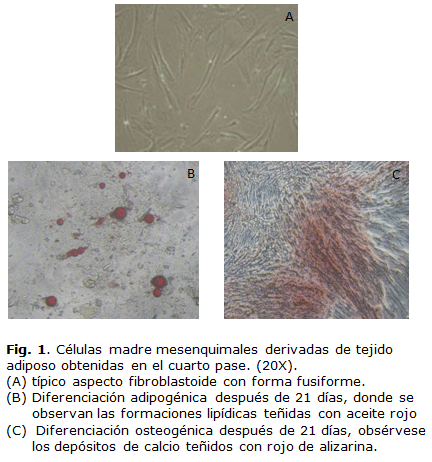
La capacidad de osteogénesis y adipogénesis de las ADSC aisladas se determinó al cuarto pase (P4) según lo descrito por Bernardo y cols. 28. La diferenciación a adipocitos se evaluó mediante la apariencia morfológica de gotas de lípidos teñidas con aceite rojo (Sigma-Aldrich, EUA), mientras que la diferenciación a osteocitos se determinó por tinción de los depósitos de calcio con rojo de alizarina (Sigma-Aldrich, EUA). Las células fijadas y teñidas se observaron y fotografiaron utilizando un microscopio óptico (Olympus, Japón).
Caracterización inmunofenotípica de las células mesenquimales derivadas de tejido adiposo
Se utilizaron ADSC del cuarto pase para la caracterización inmunofenotípica. Para la detección de las moléculas en la membrana plasmática, las células se incubaron durante 15 min en SSTF y SFB al 1 %, para minimizar las uniones inespecíficas. Luego, se incubaron 10 6 células por cada condición experimental, durante 15 min a 4ºC en la oscuridad, con los diferentes anticuerpos conjugados a fluoróforos. Todos los marcajes se realizaron en un volumen de 100 mL de SSTF. Se emplearon anticuerpos conjugados a isocianato de fluoresceína (FITC) o a ficoeritrina (PE), específicos para los siguientes antígenos: CD34, CD45, CD73, CD90 y CD105, todos de BD Pharmingen (EUA).Las muestras se analizaron en citómetro de flujo Gallios (Beckman Coulter, EUA) para la identificación de los canales específicos de fluorescencia de cada anticuerpo. El procesamiento de los datos se realizó empleando el programa Flow Jo versión 7.2.2 (Tree Star, EUA).
Ensayo de proliferación de linfocitos
La sangre periférica proveniente de donantes sanos, obtenida a partir de un concentrado leucocitario, se diluyó en medio RPMI-1640 (Gibco, EUA) en proporción 1:4 (v:v). La sangre diluida se añadió a un volumen de Ficoll-Paque TM Plus (GE Healthcare, EUA) equivalente a un tercio del volumen final de la mezcla, y se centrifugó durante 20 min, a 2 000 rpm y 25oC (Hettich, Alemania). El anillo celular en la interfase entre el Ficoll y el plasma se extrajo con una micropipeta. Los linfocitos aislados se lavaron por centrifugación, con SSTF, se centrifugaron a 900 rpm durante 10 min, y se volvieron a lavar y centrifugar a 1500 rpm durante 5 min. Los leucocitos aislados (PBMC) se contaron en la cámara de Neubauer y se ajustaron a una concentración de 107 células/mL en medio RPMI-1640 y se tiñeron durante 5 min a 37ºC con carboxy fluorescein diacetate succinimidyl ester (CFSE; Life Technologies, EUA) a una concentración final de 0.5 μM. Transcurrido ese tiempo se adicionó SFB equivalente a un tercio del volumen final de la mezcla y se lavaron las células por centrifugación a 1500 rpm durante 5 min. Las células se ajustaron a una concentración final de 106 células/mL en medio RPMI-1640 suplementado con 2 mM glutamina, 100 U/mL de penicilina, 100 µg/mL de estreptomicina, 50 μM β-mercaptoetanol y SFB al 10 %. Las células se cocultivaron en placas de 24 pocillos con ADSC. Los linfocitos se activaron con concanavalina A (ConA) (5 µg/mL), se colectaron después de 72 horas y se tiñeron con un anticuerpo anti-CD3 conjugado a PE (dilucion1:100) (eBioscience, EUA) antes del conteo en el citómetro de flujo.
RESULTADOS
Ensayo de diferenciación
Las células mostraron una morfología fibroblastoide con características fusiforme (Fig. 1A) que cambió durante los ensayos de diferenciación. En la diferenciación adipogénica a la semana de estimulación con el medio adipogénico se observaron gotas de lípidos en el citoplasma, las cuales aumentaron de tamaño al cabo de tres semanas de estimulación convirtiéndose en inclusiones lipídicas en el citoplasma que fueron teñidas con el aceite rojo (Fig. 1B), con lo que se confirmó la capacidad adipogénica de estas células. Por su parte, las ADSC estimulada con el medio osteogénico a los 21 días de estimulación mostraron la presencia de depósitos de calcio que fueron teñidos con el rojo de alizarina lo que demostró su capacidad para formar hueso (Fig. 1C).
Inmunofenotipaje
Los marcadores de superficie celular determinados en las ADSC con cuatro pases demostraron que las células aisladas eran positivas para los marcadores de células mesenquimales CD73, CD90 y CD105, en cambio resultaron negativas para los marcadores hematopoyéticos CD34 y CD45, como se muestra en la tabla.
Ensayo de inhibición de la proliferación de linfocitos T
Hubo una marcada reducción (50 % aproximadamente) de la proliferación de los linfocitos T estimulados con ConA cuando se cocultivaron con ADMSC en una relación de 10:1 respectivamente (Fig. 2), este experimento se hizo por duplicado y se observó que solamente proliferó alrededor del 33 % de los linfocitos en ambas réplicas en comparación con el 61 % de proliferación de las células T estimuladas con Con A.
DISCUSIÓN
El tejido adiposo constituye una fuente alternativa de interés en la obtención y aplicación clínica de células madre, esto se debe a factores como su facilidad de extracción, su alto contenido MSC en comparación con la médula ósea y la capacidad de su expansión ex vivo, la que puede ser similar o hasta superior respecto a las células obtenidas de la médula ósea 29.
La fracción mononuclear del tejido adiposo, conocida como la fracción vascular estromal fue descrita en sus inicios como una fuente activa mitóticamente de precursores adiposos 30. Estas células recordaban a los fibroblastos morfológicamente y se demostró su capacidad para diferenciarse in vitro a preadipocitos y tejido adiposo funcional 31. Además las MSC no solo tienen la capacidad de diferenciarse a diferentes líneas celulares de origen mesodérmico: adiposas, cartilaginosas y óseas 32, 33, sino que también pueden diferenciarse a células de origen endodérmico y ectodérmico 34-36. Estudios recientes refieren el uso potencial de estas células en el tratamiento de enfermedades cardiovasculares37, neurológicas38 y musculoesqueléticas39 en las que es muy importante el efecto paracrino de estas células debido a la gran cantidad de factores de secreción que producen e inducen el crecimiento y la diferenciación de las células madre órgano-específicas y además previenen el daño originado por la muerte por apoptosis40, 41.
Estas células derivadas de la fracción vascular estromal tienen marcadores de superficie similares a los de las BM-MSC14. En el presente estudio para la identificación de las ADSC se seleccionaron los marcadores: CD73, CD90 y CD105 (marcadores de MSC) así como CD34 y CD45 (marcadores de células hematopoyéticas). En los marcadores de superficie seleccionados se observó positividad para CD73, CD90 y CD105, con más del 96 % de expresión. En cambio menos del 3 % de las células en estudio expresan los marcadores leucocitarios CD34 y CD45.
Las células mantuvieron su fenotipo fusiforme durante los diferentes pases realizados durante el período de estudio y se comprobó su potencial de diferenciación a adipocitos y a osteocitos. Además, las ADSC obtenidas inhibieron la proliferación de células T, cualidad muy importante por su potencial uso en el trasplantes alogénico de médula ósea. Como se ha informado, las BM-MSC se pueden utilizar como tratamiento para la EICH por su capacidad para suprimir la alorreactividad en reacciones de linfocitos mixtos42. Esta capacidad antiproliferativa es compartida por todas las células del estroma16. Como una alternativa a las BM-MSC para el tratamiento de la EICH aguda se han utilizados MSC derivadas de tejido adiposo, de cordón umbilical y de placenta43-45. La médula ósea se obtiene por aspiración mediante anestesia del paciente en un salón de operaciones, por lo que esta fuente de MSC ha sido desplazada por las MSC de tejido adiposo y el cordón umbilical que son fuentes más accesibles sin ningún procedimiento invasivo y con menos conflictos éticos 43-45. Cabe destacar que las MSC también se han utilizado para evitar y tratar el rechazo de órganos sólidos 24, 46-49 .
En las condiciones descritas es posible la obtención, mediante cultivo in vitro, de ADMSC sin inducción adipogénica espontánea, que mantienen su integridad funcional y altos niveles de proliferación. Estas células demostraron potencial de diferenciación adipogénico y osteogénico in vitro, así como su potencial para inhibir la proliferación linfocitaria. Por lo tanto pueden ser una herramienta útil para las instituciones médicas en la prevención y tratamiento de la EICH, del rechazo del trasplante renal, en el tratamiento de enfermedades autoinmunes, así como en la Medicina Regenerativa.
REFERENCIAS BIBLIOGRÁFICAS
1. Rubio D, Garcia-Castro J, Martin MC, de la Fuente R, Cigudosa JC, Lloyd AC, et al. Spontaneous human adult stem cell transformation. Cancer research. 2005 Apr;65(8):3035-9.
2. Butler DL, Juncosa-Melvin N, Boivin GP, Galloway MT, Shearn JT, Gooch C, et al. Functional tissue engineering for tendon repair: A multidisciplinary strategy using mesenchymal stem cells, bioscaffolds, and mechanical stimulation. J Orthop Res. 2008 Jan;26(1):1-9.
3. Moshaverinia A, Xu X, Chen C, Ansari S, Zadeh HH, Snead ML, et al. Application of stem cells derived from the periodontal ligament or gingival tissue sources for tendon tissue regeneration. Biomaterials. 2014 Mar;35(9):2642-50.
4. Strem BM, Hicok KC, Zhu M, Wulur I, Alfonso Z, Schreiber RE, et al. Multipotential differentiation of adipose tissue-derived stem cells. Keio J Med. 2005 Sep;54(3):132-41 .
5. Shahdadfar A, Fronsdal K, Haug T, Reinholt FP, Brinchmann JE. In vitro expansion of human mesenchymal stem cells: choice of serum is a determinant of cell proliferation, differentiation, gene expression, and transcriptome stability. Stem Cells. 2005 Oct;23(9):1357-66.
6. Gang EJ, Jeong JA, Hong SH, Hwang SH, Kim SW, Yang IH, et al. Skeletal myogenic differentiation of mesenchymal stem cells isolated from human umbilical cord blood. Stem Cells. 2004;22(4):617-24.
7. Gimble JM, Guilak F, Nuttall ME, Sathishkumar S, Vidal M, Bunnell BA. In vitro Differentiation Potential of Mesenchymal Stem Cells. Transfus Med Hemother. 2008;35(3):228-38.
8. Ha CW, Park YB, Chung JY, Park YG. Cartilage Repair Using Composites of Human Umbilical Cord Blood-Derived Mesenchymal Stem Cells and Hyaluronic Acid Hydrogel in a Minipig Model. Stem Cells Transl Med. 2015 Sep;4(9):1044-51.
9. Zuk PA, Zhu M, Ashjian P, De Ugarte DA, Huang JI, Mizuno H, et al. Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell. 2002 Dec;13(12):4279-95.
10. Zuk PA, Zhu M, Mizuno H, Huang J, Futrell JW, Katz AJ, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Eng. 2001 Apr;7(2):211-28.
11. Young RG, Butler DL, Weber W, Caplan AI, Gordon SL, Fink DJ. Use of mesenchymal stem cells in a collagen matrix for Achilles tendon repair. J Orthop Res. 1998 Jul;16(4):406-13.
12. Boquest AC, Shahdadfar A, Brinchmann JE, Collas P. Isolation of stromal stem cells from human adipose tissue. Methods Mol Biol (Clifton, NJ). 2006;325:35-46.
13. Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytother. 2006;8:315 - 7.
14. De Ugarte D, Alfonso Z, Zuk P, Elbarbary A, Zhu M, Ashjian P. Differential expression of stem cell mobilization-associated molecules on multi-lineage cells from adipose tissue and bone marrow. Immunol letters. 2003;89:267 - 70.
15. Kimbrel E, Kouris N, Yavanian G, Chu J, Qin Y, Chan A. Mesenchymal stem cell population derived from human pluripotent stem cells displays potent immunomodulatory and therapeutic properties. Stem Cells Dev. 2014;23:1611 - 24.
16. Abumaree M, Al Jumah M, Pace RA, Kalionis B. Immunosuppressive properties of mesenchymal stem cells. Stem Cell Rev. 2012 Jun;8(2):375-92.
17. Selmani Z, Naji A, Gaiffe E, Obert L, Tiberghien P, Rouas-Freiss N, et al. HLA-G is a crucial immunosuppressive molecule secreted by adult human mesenchymal stem cells. Transplantation. 2009 May 15;87(9 Suppl):S62-6.
18. Naji A, Rouas-Freiss N, Durrbach A, Carosella ED, Sensebe L, Deschaseaux F. Concise review: combining human leukocyte antigen G and mesenchymal stem cells for immunosuppressant biotherapy. Stem Cells. 2013 Nov;31(11):2296-303.
19. Soleymaninejadian E, Pramanik K, Samadian E. Immunomodulatory properties of mesenchymal stem cells: cytokines and factors. Am JReprod Immunol. 2012 Jan;67(1):1-8.
20. Ungerer C, Quade-Lyssy P, Radeke HH, Henschler R, Konigs C, Kohl U, et al. Galectin-9 is a suppressor of T and B cells and predicts the immune modulatory potential of mesenchymal stromal cell preparations. Stem Cells Dev. 2014 Apr 1;23(7):755-66.
21. Zhang L, Liu D, Pu D, Wang Y, Li L, He Y, et al. The role of Toll-like receptor 3 and 4 in regulating the function of mesenchymal stem cells isolated from umbilical cord. Int J Mol Med. 2015 Apr;35(4):1003-10.
22. Squillaro T, Peluso G, Galderisi U. Clinical Trials with Mesenchymal Stem Cells: An Update. Cell Transplant. 2016;25(5):829-48. doi: 10.3727/096368915X689622.
23. Lopez-Santalla M, Mancheno-Corvo P, Menta R, Lopez-Belmonte J, DelaRosa O, Bueren JA, et al. Human Adipose-Derived Mesenchymal Stem Cells Modulate Experimental Autoimmune Arthritis by Modifying Early Adaptive T Cell Responses. Stem Cells. 2015 Dec;33(12):3493-503.
24. von Dalowski F, Kramer M, Wermke M, Wehner R, Rollig C, Alakel N, et al. Mesenchymal Stromal Cells for Treatment of Acute Steroid-Refractory GvHD: Clinical Responses and Long-Term Outcome. Stem Cells. 2016 Feb;34(2):357-66. doi: 10.1002/stem.2224.
25. English K, Wood KJ. Mesenchymal stromal cells in transplantation rejection and tolerance. Cold Spring Harbor perspectives in medicine. 2013 May;3(5):a015560.
26. Mizuno H, Hyakusoku H. Mesengenic potential and future clinical perspective of human processed lipoaspirate cells. J Nippon Med School. 2003 Aug;70(4):300-6.
27. Bunnell BA, Flaat M, Gagliardi C, Patel B, Ripoll C. Adipose-derived stem cells: isolation, expansion and differentiation. Methods (San Diego, Calif). 2008 Jun;45(2):115-20.
28. Bernardo ME, Avanzini MA, Perotti C, Cometa AM, Moretta A, Lenta E, et al. Optimization of in vitro expansion of human multipotent mesenchymal stromal cells for cell-therapy approaches: further insights in the search for a fetal calf serum substitute. J Cell Physiol. 2007 Apr;211(1):121-30.
29. Liu CH, Hwang SM. Cytokine interactions in mesenchymal stem cells from cord blood. Cytokine. 2005 Dec 21;32(6):270-9.
30. Hollenberg CH, Vost A. Regulation of DNA synthesis in fat cells and stromal elements from rat adipose tissue. J Clin Invest. 1969 Nov;47(11):2485-98.
31. Odegaard JI, Ricardo-Gonzalez RR, Goforth MH, Morel CR, Subramanian V, Mukundan L, et al. Macrophage-specific PPARgamma controls alternative activation and improves insulin resistance. Nature. 2007 Jun 28;447(7148):1116-20.
32. Bunnell BA, Estes BT, Guilak F, Gimble JM. Differentiation of adipose stem cells. Methods Mol Biol(Clifton, NJ). 2008;456:155-71.
33. Portmann-Lanz CB, Schoeberlein A, Portmann R, Mohr S, Rollini P, Sager R, et al. Turning placenta into brain: placental mesenchymal stem cells differentiate into neurons and oligodendrocytes. AZm J Obstet Gynecol. 2010 Mar;202(3):294 e1- e11.
34. den Haan MC, Grauss RW, Smits AM, Winter EM, van Tuyn J, Pijnappels DA, et al. Cardiomyogenic differentiation-independent improvement of cardiac function by human cardiomyocyte progenitor cell injection in ischaemic mouse hearts. J Cell Mol Med. 2012 Jul;16(7):1508-21.
35. Ramachandran S, Suguihara C, Drummond S, Chatzistergos K, Klim J, Torres E, et al. Bone marrow-derived c-kit+ cells attenuate neonatal hyperoxia-induced lung injury. Cell Transplant. 2015;24(1):85-95.
36. Gutierrez-Fernandez M, Rodriguez-Frutos B, Ramos-Cejudo J, Teresa Vallejo-Cremades M, Fuentes B, Cerdan S, et al. Effects of intravenous administration of allogenic bone marrow- and adipose tissue-derived mesenchymal stem cells on functional recovery and brain repair markers in experimental ischemic stroke. Stem Cell Res Ther. 2013;4(1):11.
37. Bagno LL, Werneck-de-Castro JP, Oliveira PF, Cunha-Abreu MS, Rocha NN, Kasai-Brunswick TH, et al. Adipose-derived stromal cell therapy improves cardiac function after coronary occlusion in rats. Cell Transplant. 2012;21(9):1985-96.
38. Heo JS, Choi SM, Kim HO, Kim EH, You J, Park T, et al. Neural transdifferentiation of human bone marrow mesenchymal stem cells on hydrophobic polymer-modified surface and therapeutic effects in an animal model of ischemic stroke. Neuroscience. 2013 May;238:305-18.
39. Pecanha R, Bagno LL, Ribeiro MB, Robottom Ferreira AB, Moraes MO, Zapata-Sudo G, et al. Adipose-derived stem-cell treatment of skeletal muscle injury. J Bone Joint Surg Am. 2012 Apr 4;94(7):609-17.
40. Mezey E. The therapeutic potential of bone marrow-derived stromal cells. J Cell Biochem. 2011 Oct;112(10):2683-7.
41. Fidelis-de-Oliveira P, Werneck-de-Castro JP, Pinho-Ribeiro V, Shalom BC, Nascimento-Silva JH, Costa e Souza RH, et al. Soluble factors from multipotent mesenchymal stromal cells have antinecrotic effect on cardiomyocytes in vitro and improve cardiac function in infarcted rat hearts. Cell Transplant. 2012;21(5):1011-21.
42. Muroi K, Miyamura K, Okada M, Yamashita T, Murata M, Ishikawa T, et al. Bone marrow-derived mesenchymal stem cells (JR-031) for steroid-refractory grade III or IV acute graft-versus-host disease: a phase II/III study. Int J Hematol. 2016 Feb;103(2):243-50.
43. Fang B, Song Y, Liao L, Zhang Y, Zhao RC. Favorable response to human adipose tissue-derived mesenchymal stem cells in steroid-refractory acute graft-versus-host disease. Transplant Proc. 2007 Dec;39(10):3358-62.
44. Fan X, Gay FP, Ong SY, Ang JM, Chu PP, Bari S, et al. Mesenchymal stromal cell supported umbilical cord blood ex vivo expansion enhances regulatory T cells and reduces graft versus host disease. Cytother. 2013 May;15(5):610-9.
45. Ringden O, Erkers T, Nava S, Uzunel M, Iwarsson E, Conrad R, et al. Fetal membrane cells for treatment of steroid-refractory acute graft-versus-host disease. Stem Cells. 2013 Mar;31(3):592-601.
46. English K, Mahon BP, Wood KJ. Mesenchymal stromal cells; role in tissue repair, drug discovery and immune modulation. Current drug delivery. 2014;11(5):561-71.
47. Popp FC, Fillenberg B, Eggenhofer E, Renner P, Dillmann J, Benseler V, et al. Safety and feasibility of third-party multipotent adult progenitor cells for immunomodulation therapy after liver transplantation--a phase I study (MISOT-I). Journal of translational medicine. 2011;9:124..
48. Cortinovis M, Casiraghi F, Remuzzi G, Perico N. Mesenchymal stromal cells to control donor-specific memory T cells in solid organ transplantation. Curr Opin Organ Transplant. 2015 Feb;20(1):79-85. doi: 10.1097/MOT.0000000000000145.
49. Casiraghi F, Perico N, Cortinovis M, Remuzzi G. Mesenchymal stromal cells in renal transplantation: opportunities and challenges. Nat Rev Nephrol. 2016 Apr;12(4):241-53. doi: 10.1038/nrneph.2016.7.
Recibido: diciembre
12, 2015.
Aceptado:
mayo 13, 2016.
DrC. José Armando Galván Cabrera . Instituto de Hematología e Inmunología. Apartado 8070, La Habana, CP 10800, CUBA. Tel (537) 643 8695, 8268. Email: rchematologia@infomed.sld.cu