ARTÍCULO DE REVISIÓN
Utilidad del cariotipo y la citometría de flujo en el mieloma múltiple
Utility of karyotype and flow cytometry in multiple myeloma
Lina María Martínez Sánchez, Luis Felipe Álvarez Hernández, Camilo Ruiz Mejía, Juan Diego Villegas Álzate
Universidad Pontificia Bolivariana, Medellín, Colombia.
RESUMEN
Introducción:
el mieloma múltiple tiene una incidencia aproximada de 3,5 a 6 casos
por 100 000 personas por año; es la segunda neoplasia hematológica
más común y representa más del 10 % de los casos de malignidades
hematológicas.
Objetivo:
revisar los principales patrones genéticos del mieloma múltiple a
través de la citometría de flujo multiparamétrica y cariotipo,
resaltando sus ventajas y desventajas.
Métodos:
se realizó una revisión bibliográfica exhaustiva desde septiembre
de 2017 hasta marzo de 2018 en bases de datos como Medline, Science Direct,
Lilacs y Embase, en inglés y español, con los términos MeSH de
búsqueda: mieloma múltiple, citometría de flujo, cariotipo, genética,
diagnóstico.
Resultados:
a pesar de que existen otros métodos diagnósticos empleados en
el mieloma múltiple, la citometría de flujo multiparamétrica
y el cariotipo siguen siendo los más utilizados.
Conclusión: la citometría de flujo multiparamétrica es
un pilar en la inmunofenotipificación y el monitoreo de las neoplasias
hematológicas, junto con la clínica del paciente, los resultados paraclínicos
y la evaluación morfológica de la sangre, además de ser parte
de la valoración inicial por la capacidad de aportar resultados concluyentes
en poco tiempo.
Palabras clave: mieloma múltiple; citometría de flujo multiparamétrica; cariotipo; genética.
ABSTRACT
Introduction:
Multiple myeloma has an approximate incidence of 3.5 to 6 cases per 100 000
people per year, being the second most common hematological neoplasm, representing
more than 10 % cases of hematological malignancies.
Objective: To review the main genetic patterns of multiple myeloma through
multiparametric flow cytometry and karyotype, highlighting its advantages and
disadvantages.
Methods: An exhaustive literature review was conducted from September
2017 to March 2018 in databases such as Medline, Science Direct, Lilacs and
Embase, in English and Spanish, with the MeSH terms search: multiple myeloma,
flow cytometry, karyotype, genetics, diagnosis.
Results: Although there are other diagnostic methods used in multiple
myeloma, multiparametric flow cytometry and karyotype are still the most used.
Conclusion: Multiparametric flow cytometry is a pillar in the immunophenotyping
and monitoring of hematological neoplasms, together with the patient's clinical,
paraclinical results and morphological evaluation of the blood, as well as being
part of the initial evaluation due to the ability to provide conclusive results
in a short time.
Keywords: multiple myeloma; multiparametric flow cytometry; karyotype; genetics.
INTRODUCCIÓN
Las neoplasias clonales de células plasmáticas representan un amplio espectro de enfermedades; pueden ser únicamente hallazgos incidentales en individuos asintomáticos, hasta incluso condiciones amenazantes para la vida con un gran número de manifestaciones clínicas, características morfológicas e inmunofenotipos en los que se debe identificar la célula plasmática clonal.1 En la actualidad la citometría de flujo multiparamétrica (CFM) es considerada una prueba diagnóstica obligatoria en la caracterización de células neoplásicas en un gran número de malignidades hematológicas.2
El mieloma múltiple (MM) es una neoplasia clonal de células B que se presentapor la acumulación de células plasmáticas neoplásicas en la médula ósea, en la mayoría de los casos, con la producción de una paraproteína anormal conocida como proteína monoclonal.3,4 Es una condición incurable, cuyo tratamiento depende de aspectos como la etapa de la enfermedad, la edad y el estado general de salud del paciente y; consiste principalmente en quimioterapia, radioterapia y regímenes de inmunoterapia, incluido el trasplante autólogo, que tienen como objetivo controlar y suprimir la progresión de la enfermedad.5
Tiene una incidencia aproximada de 3,5 a 6 casos por 100 000 personas por año y es la segunda neoplasia hematológica más común. Representa el 0,8 % de todos los casos de cáncer y más del 10 % los casos de malignidades hematológicas.2,4,6 La etapa premaligna asintomática de la enfermedad se denomina gammapatía monoclonal de significado incierto (MGUS) presente en aproximadamente el 3 al 4 % de las personas mayores de 50 años; el riesgo de progresión de MGUS a MM es del 1 % por año aproximadamente, mientras que la progresión a enfermedad maligna en los primeros 5 años después del diagnóstico es del 10 % por año.6 Es una condición clínica y molecular heterogénea, con una supervivencia global que oscila desde menos de 1 año hasta más de 20 años.7
El diagnóstico de esta condición se confirma mediante la identificación de células plasmáticas neoplásicas en la médula ósea al igual que la detección de la proteína monoclonal en muestras de sangre u orina.3 A pesar de que la mayoría de las células plasmáticas de pacientes con MM son neoplásicas, un pequeño porcentaje son célulasnormales o reactivas, las cuales son responsables de mantener la función inmune. La CFMes la herramienta diagnóstica fundamental para diferenciar ambos tipos de células plasmáticas (reactivas de neoplásicas).3,8 La CFM representa una parte integral en la evaluación paraclínica y el manejo de diferentes neoplasias hematológicas, entre ellas el MM, y es fundamental en el diagnóstico, clasificación, estadificación pronóstica y seguimiento terapéutico de estas malignidades.1
El presente trabajo tiene como objetivo hacer una revisión general acerca de las generalidades del MM, con especial énfasis en la utilidad de la CFM como herramienta en el diagnóstico y pronóstico de esta condición.
DIAGNÓSTICO
La aparición de un pico monoclonal en sangre u orina es un hallazgo habitual en la práctica clínica, son muchas las enfermedades capaces de causarlo y, conseguir llegar al diagnóstico definitivo es fundamental para un tratamiento adecuado para el paciente.9 Siempre que suceda un pico anormal de inmunoglobulinas se debe descartar la etiología maligna y una discrasia de células plasmáticas, para esto se debe de realizar un enfoque diagnóstico para comprobar la presencia de un desorden clonal y confirmar la presencia de una paraproteína en suero, determinar si hay daño de órgano blanco presente, buscar la extensión de la masa tumoral y evaluar el pronóstico del paciente.10-13 Inicialmente el enfoque debe incluir los siguientes exámenes de laboratorio:9,11,13-17
- Laboratorio hematológico: hemoleucograma completo, eritrosedimentación y hemostasia.
- Química sanguínea: urea, creatinina sérica, depuración de creatinina, calcio sérico, lactato deshidrogenasa (LDH), hepatograma, péptido natriurético cerebral (Pro-BNP) y troponinas.
- Evaluación de proteínas: albúmina sérica, β2 microglobulina, niveles de inmunoglobulinas (IgG, IgA, IgM; en caso de ser negativas realizar inmunofijación para IgD e IgE). Para el tamizaje rápido y sensible de la presencia de una inmunoglobulina monoclonal se recomienda la electroforesis en gel de agarosa, tanto en sangre como en orina.
- Ensayo de cadena ligera libre (CLL) en suero que permite evaluar la proporción de cadenas ligeras (CL) de suero kappa/lambda (por medio de pruebas como Freelite®, Seralite®).
- Electroforesis e inmunofijación de proteínas en orina de 24 h.
Los estudios imagenológicos iniciales son importantes para evaluar las
lesiones osteolíticas características del MM. Estas imágenes
son indicadas tanto para el diagnóstico inicial de la enfermedad como para
el seguimiento de esta. Inicialmente se puedenrealizar rayos-X de cráneo,
pelvis, esqueleto axial y apendicular; sin embargo, la tomografía computarizada
(TC), la tomografía por emisión de positrones (PET-CT) o resonancia
magnética (RM) pueden detectar hasta 80 % más de lesiones, en comparación
con los rayos-X simples y, se recomiendan en caso de sospecha de lesiones extraóseas,
plasmocitomas solitarios o como evaluación de la respuesta del tratamiento.11,13,18,19
Otras herramientas diagnósticas son la biopsia del tejido adiposo de la pared abdominal que se debe teñir con rojo Congo para hacer el diagnóstico diferencial de una amiloidosis. Adicionalmente se puede evaluar la viscosidad sérica ya que la hiperviscosidad debida a niveles aumentados de IgM en la macroglobulinemia de Waldeström puede ser causa de un grave deterioro clínico.11,16
Es importante aclarar, que no solo los exámenes complementarios son importantes para el diagnóstico, sino también la sospecha clínica, la cual debe iniciar con la sintomatología del paciente. En el caso del MM, es muy característica la presencia de anemia, hipercalcemia, insuficiencia renal y lesiones osteolíticas.9
Una vez que se llevan a cabo todas las pruebas iniciales, se debe realizar una estadificación clínica de acuerdo con los criterios del Grupo Internacional de Trabajo sobre el Mieloma (IMWG). Inicialmente, los desórdenes de células plasmáticas se presentan con una fase premaligna conocida como MGUS, caracterizada por aparición de una población clonal de células plasmáticas con producción de una inmunoglobulina clonal, que puede evolucionar posteriormente a una fase denominada "mieloma múltiple indolente o asintomático (SMM)" y finalmente al "MM sintomático".11,13,20 La tabla 1 resume esta clasificación.10-12,17,20-22
Adicional a estos criterios, están los criterios CRAB (del inglés Calcium Renal insufficiency Anemia or Bone lesions) que determinan si hay sintomatología derivada de afectación de órganos o tejidos por el MM, lo cual habla también de la gravedad de la enfermedad;11 entre estos se encuentran:23
- Hipercalcemia: calcio sérico > 1 mg/dL sobre el límite superior normal o > 11 mg/dL en total.
- Insuficiencia renal: depuración de creatinina < 40 mL/min o creatinina sérica > 2 mg/dL.
- Anemia: hemoglobina < 2 g/dL debajo del límite inferior normal o < 10 g/dL en total.
- Lesiones óseas: una o más lesiones osteolíticas en los rayos-X, TC o PET-TC.
El MM es una enfermedad heterogénea en la cual aspectos como presentación
clínica, morfología celular, inmunofenotipo y alteraciones genéticas
específicas son fundamentales para lograr un tratamiento adecuado.24
Actualmente varias herramientas diagnósticas como el estudio citogenético
convencional (cariotipo) y técnicas genéticas moleculares como la
hibridación in situ con fluorescencia (FISH) se utilizan para el
diagnóstico, la evaluación de riesgos y el control de la enfermedad
durante el tratamiento.24 El medulograma y la biopsia medular son
exámenes rutinarios primordiales en el estudio de la gammapatía monoclonal
por su alto valor pronóstico y su especificidad diagnóstica ya que
permiten la realización de un reporte morfológico y de pruebas inmunohistoquímicas
para la detección de CD38, CD138 y k/λ citoplasmáticas.24,25
Igualmente, el estudio de la medula ósea permite la inmunofenotipificación
por medio de la citometría de flujo para la identificación de: k/λ
citoplasmáticas, CD38, CD138, CD56, CD45, CD19, CD20, CD117, CD27, CD28
y CD81.11,13
Si bien el estudio citogenético convencional ofrece una vista completa de los cromosomas, el ensayo podría detectar aproximadamente hasta el 30 % de las anomalías citogenéticas en el MM debido a la baja actividad mitótica de las células en esta enfermedad y la baja resolución de la técnica, por esta razón el FISH ha sido diseñado para superar estas deficiencias del análisis citogenético convencional.24
PATRONES GENÉTICOS
EN LA CFM DE FLUJO DE LOS PACIENTES CON MM
La CFM es un pilar en la inmunofenotipificación necesaria para el diagnóstico y el monitoreo de la mayoría de las neoplasias hematológicas, junto con la clínica del paciente, resultados paraclínicos y evaluación morfológica de la sangre; además de ser parte de la evaluación inicial por la capacidad de aportar resultados concluyentes en poco tiempo.6
La CFM permite realizar la inmunofenotipificación e identificación de células plasmáticas ya que estas son positivas para CD38 y CD138. Adicionalmente, facilita la diferenciación de células plasmáticas normales de las malignas, pues las primeras tienen una alta expresión de CD19 y CD45 en su superficie, mientras que las células malignas carecen de estos antígenos o los expresan en muy baja densidad. Por el contrario, las células plasmáticas normales no expresan los antígenos CD56 y CD117, respectivamente o lo hacen muy débilmente; mientras que las células plasmáticas malignas tienen una alta expresión de estos.11 Otras características del MM se resumen en la tabla 2.1,3,10,12,13,17,21,26-42
Ventajas del
uso de la CFM
La CFM es un método que se puede aplicar en más del 90 % de los casos y en comparación con la reacción en cadena de la polimerasa (PCR) tiene menor costo y es más rápido; además de tener reproducibilidad y una alta sensibilidad.43 Por lo anterior, la CFM es necesaria para establecer el diagnóstico diferencial y clasificar el desorden de las células plasmáticas, además para estratificar el MGUS y MM y monitorear la enfermedad mínima residual.44
PATRONES GENÉTICOS EN EL CARIOTIPO DE LOS PACIENTES CON MM
El MM surge de las células B diferenciadas terminales e incluso de las células B del centro germinal, que clínicamente se manifiestan como células plasmáticas mal diferenciadas.11 En situaciones normales, las células plasmáticas actúan produciendo inmunoglobulinas, para esto, las células B se someten a una reorganización del gen de la inmunoglobulina y a cambios de la afinidad en respuesta a antígenos presentados por células presentadoras de antígeno dentro del centro germinal de los nódulos linfáticos.11 Para que esto suceda se requiere de mutaciones programadas de las regiones variables de la cadena pesada de la inmunoglobulina (IGH en el cromosoma 14q32). En el MM se genera una desregulación de la ciclina D causada por translocaciones anormales del IGH y copias aumentadas de cromosomas impares. La secuenciación del genoma de estos pacientes puede confirmar la presencia de este tipo de alteraciones genéticas tempranas al igual que los eventos genéticos secundarios que incluyen mutaciones del oncogen myc, mutaciones en la vía del factor nuclear-κβ (NF-κβ) y otras anomalías cromosómicas como deleciones, amplificaciones o adiciones.11,42 Existe otra translocación cromosómica que es frecuente en el MM donde se sobrexpresa la ciclina D1, es la t(11;14), que interviene en la fosforilación de la proteína del retinoblastoma; además, se ha logrado identificar que entre el 20 % y el 25 % de los pacientes con diagnóstico nuevo, pueden llegar a tener anormalidades en el cromosoma 13.45 Otras alteraciones genéticas características del MM pueden encontrarse en la tabla 2.1,3,10,12,13,17,21,26-42
Ventajas del
uso del cariotipo
La fácil aplicabilidad del cariotipo en cuanto al seguimiento del paciente representa una gran ventaja, ya que puede ayudar a establecer el pronóstico de los pacientes tratados con quimioterapia con un resultado de cariotipo anormal vs normal.45 El cariotipo es uno de los métodos estandarizados de mayor uso, en donde se pueden diagnosticar alrededor del 80 % de todos los casos. Sin embargo, se habla de una superioridad notable del FISH frente al cariotipo para la identificación de anomalías genéticas.46
La heterogeneidad citogenética en pacientes con MM detectado por cariotipo convencional y FISH, demuestran que el análisis cromosómico convencional sigue siendo muy valioso para la evaluación de riesgo y como complemento de los datos del FISH, especialmente si se trata de genética de alta resolución cuando las técnicas de microarreglos no se encuentran disponibles.7
DIFERENCIAS DE OTRAS GAMMAPATÍAS MONOCLONALES MÚLTIPLES
El MM se debe diferenciar de otras gammapatías monoclonales que puedan tener similares manifestaciones clínicas o de laboratorio para que de esta manera se pueda hacer un tratamiento dirigido y efectivo. Entre los principales diagnósticos diferenciales están el síndrome de POEMS (cuyo nombre proviene de polineuropatía, órganomegalia, endocrinopatía, proteína monoclonal y cambios en la piel), la macroglobulinemia de Waldeström y la amiloidosis. El síndrome de POEMS es un trastorno monoclonal de células plasmáticas que se acompaña de neuropatía periféricaque es poco común en el MM clásico; por el contrario, la presencia de anemia, hipercalcemia, insuficiencia renal, fracturas patológicas y un alto porcentaje de células plasmáticas en la médula ósea son más características del MM que del síndrome de POEMS.19,41,47,48
En la mayoría de los casos, la distinción entre macroglobulinemia de Waldeström y el MM es fácil y directa, ya que las características clínicas son diferentes y el tipo de proteína monoclonal que se observa en la macroglobulinemia de Waldeström es único (IgM).40 Adicionalmente, existen diferencias en los patrones inmunofenotípicos de ambas condiciones en la biopsia de medula ósea; enlos pacientes con macroglobulinemia de Waldeström las células plasmáticas no expresan CD56 mientras que si expresan CD19 y CD20, contrario a lo observado en pacientes con MM. De igual forma, en el estudio FISH existe una alta frecuencia de deleción 6q en pacientes con macroglobulinemia de Waldeström, hallazgo poco frecuente en pacientes con MM.39,49
Generalmente, en la amiloidosis hay menos del 20 % de infiltración de células plasmáticas en médula ósea en comparación con los pacientes con MM.35-37 Además, los pacientes con amiloidosis tienden a presentar menos lesiones óseas líticas en las imágenes y una cantidad moderada de proteinuria de Bence Jones.35-37
MARCADORES PRONÓSTICOS
El MM es una enfermedad heterogénea, ya que algunos pacientes fallecen a las pocas semanas del diagnóstico, mientras otros viven más de 10 años; en general se considera que la supervivencia a los cinco años no supera el 40 %.10,13,50 La estratificación del riesgo puede arrojar información sobre la biología de la enfermedad subyacente y el curso esperado. Adicionalmente, estos estudios de pronóstico pueden ayudar a dar criterios de inclusión para ensayos clínicos y pueden ayudar a guiar el tratamiento.11-13,20
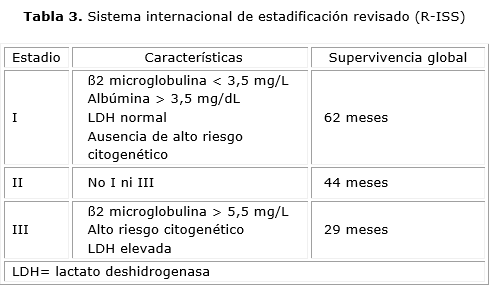
El Sistema Internacional de Estadificación (ISS) fue establecido en 2005, por el IMWG después de un estudio en el que la β2-microglobulina y la albúmina fueron fuertemente correlacionados con la mediana de supervivencia, los pacientes pudieron clasificarse en tres etapas según los niveles séricos en el momento del diagnóstico; tiempo después se publicaron los criterios revisados o R-ISS los cuales incluyen adicionalmente factores intrínsecos tumorales (como lo es la citogenética y FISH) (tabla 3).11,13,20
Además del ISS, los pacientes pueden estratificarse en categorías de riesgo citogenético estándar, intermedio y alto según los hallazgos del cariotipo convencional o FISH (tabla 4).11,13,25
Existen otros factores pronósticos que intervienen en el desarrollo de
la enfermedad como la proteína C reactiva, ya que cuando es mayor de 6
mg/L, funciona con un factor desfavorable. Además, parece ser que la RM
relaciona la respuesta del tratamiento y la supervivencia del paciente con el
número de lesiones encontradas.50
ALTERACIONES MOLECULARES
Existen diferentes genes que participan en la presentación del MM, entre los cuales se pueden encontrar oncogenes apoptóticos y oncogenes promotores del crecimiento:45
Oncogenes antiapoptóticos
- Bcl-2: solo hay evidencia que entre el 5 % y el 15 % de los pacientes con MM pueden llegar a presentar translocaciones de este gen. No obstante, entre el 80 % y el 100 % de los que lo tienen expresado, lo hacen en niveles altos.
- Bcl-x: afecta principalmente a los pacientes diagnosticados con MM que se encuentran bajo tratamiento quimioterapéutico.
- FGFR3 (receptor 3 del factor de crecimiento de fibroblastos): está alterado en el 25 % de los pacientes con MM; genera un aumento de la expresión de STAT1, STAT5a y STAT5b y aumenta el crecimiento tumoral por generación específica de citosinas.45
Oncogenes promotores del crecimiento
- ras: del 30 % al 47 % de los pacientes con diagnóstico de MM, pueden tener mutaciones relacionadas al N-ras o al H-ras.
- p53: asociado con la resistencia a quimioterapia y mal pronóstico del MM, presenta una incidencia que varía entre 13 % y 24 % en estos pacientes.
- c-myc: con una frecuencia del 53 % con técnicas de inmunocitoquímica.
- c-maf: mutado o sobrexpresado entre el 80 % y el 100 % de los pacientes con MM.45
CONSIDERACIONES FINALES
El MM es una condición asociada a altas tasas de morbimortalidad. El diagnóstico de esta condición se hace mediante la identificación de células plasmáticas neoplásicas en la médula ósea; sin embargo, la CFM es fundamental en la clasificación y estratificación pronóstica de esta condición, al igual que en su seguimiento a largo plazo y en la evaluación de la respuesta al tratamiento.
REFERENCIAS BIBLIOGRÁFICAS
1. Kumar S, Kimlinger T, Morice W. Immunophenotyping in multiple myeloma and related plasma cell disorders. Best Pract Res Clin Haematol. 2010;23(3):433-51.
2. Paiva B, Almeida J, Pérez-Andrés M, Mateo G, López A, Rasillo A, et al. Utility of flow cytometry immunophenotyping in multiple myeloma and other clonal plasma cell-related disorders. Cytometry B Clin Cytom. 2010;78(4):239-52.
3. Jeong TD, Park CJ, Shim H, Jang S, Chi HS, Yoon DH, et al. Simplified flow cytometric immunophenotyping panel for multiple myeloma, CD56/CD19/CD138(CD38)/CD45, to differentiate neoplastic myeloma cells from reactive plasma cells. Korean J Hematol. 2012;47(4):260-6.
4. Galtseva IV, Davydova YO, Kapranov NM, Julhakyan HL, Mendeleeva LP. Minimal residual disease in multiple myeloma: Benefits of flow cytometry. Int J Lab Hematol. 2018;40(1):12-20.
5. Monterosso L, Taylor K, Platt V, Lobb E, Musiello T, Bulsara C, et al. Living With Multiple Myeloma: A Focus Group Study of Unmet Needs and Preferences for Survivorship Care. J Patient Exp. 2018;5(1):6-15.
6. Jelinek T, Bezdekova R, Zatopkova M, Burgos L, Simicek M, Sevcikova T. Current applications of multiparameter flow cytometry in plasma cell disorders. Blood Cancer J. 2017;7(10):e617.
7. Hao S, Lin P, Medeiros LJ, Fang L, Carballo-Zarate AA, Konoplev SN. Clinical implications of cytogenetic heterogeneity in multiple myeloma patients with TP53 deletion. Mod Pathol. 2017;30(10):1378-86.
8. Cannizzo E, Bellio E, Sohani AR, Hasserjian RP, Ferry JA, Dorn ME, et al. Multiparameter immunophenotyping by flow cytometry in multiple myeloma: The diagnostic utility of defining ranges of normal antigenic expression in comparison to histology. Cytometry B Clin Cytom. 2010 Jul;78(4):231-8.
9. Molina-Garrido JM, Guillén-Ponce C, Guirado-Risueño M, Martínez-Sevilla C, Carrato A. Diagnóstico diferencial de las gammapatías monoclonales. An Med Interna. 2006 Nov;23(11):546-51.
10. Borja JN, Mancero CM, Bravo RC, Morales RE. Mieloma múltiple: aspectos biológicos, clínicos, diagnóstico, tratamiento con nuevos agentes y estadificación. Revisión de dos casos clínicos. Medicina (Mex). 2014;18(2):87-94.
11. Lee HC, Patel K, Kongtim P, Parmar S, Lin P, Qazilbash MH, et al. Multiple Myeloma and Other Plasma Cell Dyscrasias. The MD Anderson Manual of Medical Oncology, 3 ed, New York: McGraw-Hill Medical; 2016.
12. Kyle RA, Rajkumar SV. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma. Leukemia. 2009 Jan;23(1):3-9.
13. Corzo A, Duarte P, Kusminsky G, Ochoa P, Orlando S, Quiroga L, et al. Gammapatías monoclonales. Sociedad Argentina de Hematología. Guías de diagnóstico y tratamiento. 2017. (Accedido: febrero 25, 2018). Disponible en: http://sah.org.ar/docs/2017/002-Gammapat%C3%ADas%20Monoclonales.pdf
14. Pedroza-Vázquez A, Zamora-Palma A. Utilidad de pruebas de laboratorio en el diagnóstico de mieloma múltiple. Rev Latinoam Patol Clínica Med Lab. 2015;62(1):55-62.
15. Heaney JLJ, Campbell JP, Yadav P, Griffin AE, Shemar M, Pinney JH, et al. Multiple myeloma can be accurately diagnosed in acute kidney injury patients using a rapid serum free light chain test. BMC Nephrol. 2017;18(1):247.
16. Papadakis MA, McPhee SJ. Multiple Myeloma. Quick Medical Diagnosis & Treatment 2017. New York: McGraw-Hill Education; 2017.
17. Kyle RA, Gertz MA, Witzig TE, Lust JA, Lacy MQ, Dispenzieri A, et al. Review of 1027 patients with newly diagnosed multiple myeloma. Mayo Clin Proc. 2003;78(1):21-33.
18. Bellotti-Mustecic M, Zylberberg I, Stavaru-Marinescu B, Muñoz-Guerra M, Sastre Pérez J, Diez G, et al. Diagnóstico de mieloma múltiple a raíz de una lesión osteolítica mandibular. Rev Esp Cir Oral Maxilofac. 2016;38(4):213-7.
19. Lacy MQ, Gertz MA, Hanson CA, Inwards DJ, Kyle RA. Multiple myeloma associated with diffuse osteosclerotic bone lesions: a clinical entity distinct from osteosclerotic myeloma (POEMS syndrome). Am J Hematol. 1997;56(4):288-93.
20. Rajkumar SV, Dimopoulos MA, Palumbo A, Blade J, Merlini G, Mateos MV, et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol. 2014;15(12):e538-48.
21. Munshi NC, Longo DL, Anderson KC. Plasma Cell Disorders. Harrison's Principles of Internal Medicine, 19ed. New York: McGraw-Hill Education; 2015.
22. Dispenzieri A, Kyle RA, Katzmann JA, Therneau TM, Larson D, Benson J, et al. Immunoglobulin free light chain ratio is an independent risk factor for progression of smoldering (asymptomatic) multiple myeloma. Blood. 2008;111(2):785-9.
23. García-Sanz R, Mateos M, San Miguel J. Mieloma múltiple. Med Clin (Barc). 2007;129(3):104-15.
24. Sommaluan S, Rerkamnuaychoke B, Pauwilai T, Chancharunee S, Onsod P, Pornsarayuth P, et al. The Utilization of Karyotyping, iFISH, and MLPA for the Detection of Recurrence Genetic Aberrations in Multiple Myeloma. Asian Pac J Cancer Prev. 2017;18(11):3135-42.
25. Chillón MC, Jiménez C, García-Sanz R, Alcoceba M, Prieto I, García-Alvarez M, et al. Quantitative PCR: an alternative approach to detect common copy number alterations in multiple myeloma. Ann Hematol. 2017;96(10):1699-705.
26. Fernández de Larrea C, Verga L, Morbini P, Klersy C, Lavatelli F, Foli A, et al. A practical approach to the diagnosis of systemic amyloidosis. Blood. 2015;125(14):2239-44.
27. García-Sanz R, Montoto S, Torrequebrada A, de Coca AG, Petit J, Sureda A, et al. Waldenström macroglobulinaemia: presenting features and outcome in a series with 217 cases. Br J Haematol. 2001;115(3):575-82.
28. Dimopoulos MA, Panayiotidis P, Moulopoulos LA, Sfikakis P, Dalakas M. Waldenström's macroglobulinemia: clinical features, complications, and management. J Clin Oncol. 2000;18(1):214-26.
29. Hunter ZR, Xu L, Yang G, Zhou Y, Liu X, Cao Y, et al. The genomic landscape of Waldenstrom macroglobulinemia is characterized by highly recurring MYD88 and WHIM-like CXCR4 mutations, and small somatic deletions associated with B-cell lymphomagenesis. Blood. 2014;123(11):1637-46.
30. Treon SP, Xu L, Yang G, Zhou Y, Liu X, Cao Y, et al. MYD88 L265P somatic mutation in Waldenström's macroglobulinemia. N Engl J Med. 2012;367(9):826-33.
31. Adams D, Said G. Ultrastructural characterisation of the M protein in nerve biopsy of patients with POEMS syndrome. J Neurol Neurosurg Psychiatry. 1998;64(6):809-12.
32. Bladé J, Kyle RA. Multiple myeloma in young patients: clinical presentation and treatment approach. Leuk Lymphoma. 1998;30(5-6):493-501.
33. Dao LN, Hanson CA, Dispenzieri A, Morice WG, Kurtin PJ, Hoyer JD. Bone marrow histopathology in POEMS syndrome: a distinctive combination of plasma cell, lymphoid, and myeloid findings in 87 patients. Blood. 2011;117(24):6438-44.
34. Deshmukh M, Elderfield K, Rahemtulla A, Naresh KN. Immunophenotype of neoplastic plasma cells in AL amyloidosis. J Clin Pathol. 2009;62(8):724-30.
35. Sissoko M, Sanchorawala V, Seldin D, Sworder B, Angelino K, Broce M, et al. Clinical presentation and treatment responses in IgM-related AL amyloidosis. Amyloid. 2015;22(4):229-35.
36. Madan S, Dispenzieri A, Lacy MQ, Buadi F, Hayman SR, Zeldenrust SR, et al. Clinical features and treatment response of light chain (AL) amyloidosis diagnosed in patients with previous diagnosis of multiple myeloma. Mayo Clin Proc. 2010;85(3):232-8.
37. Kyle RA, Gertz MA. Primary systemic amyloidosis: clinical and laboratory features in 474 cases. SeminHematol. 1995;32(1):45-59.
38. Schop RFJ, Kuehl WM, Van Wier SA, Ahmann GJ, Price-Troska T, Bailey RJ, et al. Waldenström macroglobulinemia neoplastic cells lack immunoglobulin heavy chain locus translocations but have frequent 6q deletions. Blood. 2002;100(8):2996-3001.
39. Treon SP, Hunter ZR, Aggarwal A, Ewen EP, Masota S, Lee C, et al. Characterization of familial Waldenstrom's macroglobulinemia. Ann Oncol. 2006 Mar;17(3):488-94.
40. Varettoni M, Zibellini S, Defrancesco I, Ferretti VV, Rizzo E, Malcovati L, et al. Pattern of somatic mutations in patients with Waldenström macroglobulinemia or IgM monoclonal gammopathy of undetermined significance. Haematologica. 2017;102(12):2077-85.
41. Li J, Zhou D-B, Huang Z, Jiao L, Duan M-H, Zhang W, et al. Clinical characteristics and long-term outcome of patients with POEMS syndrome in China. Ann Hematol. 2011;90(7):819-26.
42. Lynch HT, Watson P, Tarantolo S, Wiernik PH, Quinn-Laquer B, IsgurBergsagel K, et al. Phenotypic heterogeneity in multiple myeloma families. J Clin Oncol. 2005 Feb 1;23(4):685-93.
43. Takamatsu H. Comparison of Minimal Residual Disease Detection by Multiparameter Flow Cytometry, ASO-qPCR, Droplet Digital PCR, and Deep Sequencing in Patients with Multiple Myeloma Who Underwent Autologous Stem Cell Transplantation. J Clin Med. 2017 Sep;6(10). pii: E91.
44. Paiva B, Merino J, San Miguel JF. Utility of flow cytometry studies in the management of patients with multiple myeloma. Curr Opin Oncol. 2016;28(6):511-7.
45. Romero-García F. Novedades en mieloma múltiple. Gac Méd Méx. 2003. 139(2):131-8.
46. Stella F, Pedrazzini E, Agazzoni M, Ballester O, Slavutsky I. Cytogenetic Alterations in Multiple Myeloma: Prognostic Significance and the Choice of Frontline Therapy. Cancer Invest. 2015;33(10):496-504.
47. Shibuya K, Misawa S, Horikoshi T, Kanai K, Isose S, Nasu S, et al. Detection of bone lesions by CT in POEMS syndrome. Intern Med. 2011;50(13):1393-6
48. Dispenzieri A, Kyle RA, Lacy MQ, Rajkumar SV, Therneau TM, Larson DR, et al. POEMS syndrome: definitions and long-term outcome. Blood. 2003;101(7):2496-506.
49. Fonseca R, Hayman S. Waldenström macroglobulinaemia. Br J Haematol. 2007;138(6):700-20
50. Charlot-Lambrecht I, Salmon J, Gagneux-Lemoussu L, Brochot P, Eschard J. Mieloma múltiple. EMC-Aparato locomotor, 2012.45(1):1-13.
Recibido: 27 de
abril de 2018.
Aprobado: 17 de
julio de 2018.
Dra. Lina María
Martínez Sánchez. Universidad Pontificia Bolivariana, Sede Central
Medellín. Circular
1 No. 70-01, Medellín, Colombia.
Correo electrónico:
linam.martinez@upb.edu.co