Presentación de caso
Neutropenia febril asociada a la ingesta de metimazol: reporte de caso
Febrile neutropenia associated with methimazole ingestion: case report
Ronald
Yesid Maestre Serrano1*
Angie Cucunubá-Toloza1
Ana Teresa
Díaz-Hernández1
Cielo Estrada-Redondo1
Olivia
Silva-Sanchez1
1 Universidad Libre Seccional Barranquilla, Facultad de Ciencias de la Salud. Colombia.
*Dr. Ronald Yesid Maestre. (rmaestre@unilibrebaq.edu.co)
RESUMEN
La neutropenia se define como un recuento absoluto de neutrófilos menor a 1500 células /µL. Se debe a la disminución en la producción de granulocitos o al aumento en su destrucción, ya sea a nivel medular o periférico. Según la clasificación de la Organización Mundial de la Salud (OMS) los grados de neutropenia van de 0 a IV, de acuerdo a la magnitud de la disminución del recuento de neutrófilos. El grado IV es el de mayor riesgo y corresponde a recuentos por debajo de 500 células/µL. El impacto en la morbimortalidad asociada a la neutropenia no está vinculado con la disminución directa del recuento celular, sino con los procesos infecciosos asociados a los que son propensos los pacientes que la presentan. Existen diversas condiciones por las que se puede desarrollar neutropenia, entre las que se encuentran las infecciones, las malignidades y los fármacos. Estos últimos pueden generar eventos adversos por mecanismos dosis dependiente, como en el caso de la quimioterapia citotóxica o por una reacción idiosincrática. Se presenta el caso de una paciente femenina de 37 años de edad, con antecedentes de tirotoxicosis, tratada con propanolol y metimazol durante cuatro semanas, quien además de manifestaciones tóxicas, presentó neutropenia febril muy grave, que mejoró luego de suspensión del antitiroideo. Se pretende resaltar la asociación de neutropenia febril como complicación de uso de tionamidas y la importancia del seguimiento con exámenes de laboratorios para un diagnóstico oportuno.
Palabras clave: hipertiroidismo; tirotoxicosis; neutropenia febril; metimazol.
ABSTRACT
Neutropenia is defined as an absolute neutrophil count less than 1500 cells / μL. It is due to the decrease in the production of granulocytes or increase in their destruction, either at the medullary or peripheral level. According to the classification of the World Health Organization (WHO) the degrees of neutropenia range from 0 to IV, taking into account the magnitude of the decrease in the neutrophil count. Grade IV is the highest risk and corresponds to counts below 500 cells /μL. The impact on morbidity and mortality associated with neutropenia is not linked to the direct reduction of the cell count, but to the associated infectious processes to which patients who present it are prone. There are several conditions under which neutropenia can develop, including infections, malignancies and drugs. The latter can generate adverse effects by dose-dependent mechanisms, as in the case of cytotoxic chemotherapy or an idiosyncratic reaction. Next, the case of a female patient of thirty-seven years of age, with a history of thyrotoxicosis, treated with propanolol and methimazole for four weeks, who in addition to toxic manifestations, presents very severe febrile neutropenia that improves after suspension of the antithyroid. We aim to highlight the association of febrile neutropenia as a complication of thionamide use and the importance of follow-up with laboratory tests for an opportune diagnosis.
Keywords: hyperthyroidism; thyrotoxicosis; febrile neutropenia; methimazole.
Recibido:
28/05/2018
Aceptado:
31/10/ 2018
INTRODUCCIÓN
Los fármacos antitiroideos, se han utilizado ampliamente para tratar el hipertiroidismo; sin embargo, estos pueden generar efectos secundarios entre el 1 % y el 5 % de los pacientes tratados, entre los que se encuentran la depresión medular que incluye la pancitopenia y la agranulocitosis.(1) Esta última se presenta en el 0,1 % y 0,5 % de los pacientes y es considerado uno de los eventos adversos más importantes, ya que podría conducir a una infección grave, con un incremento de la morbimortalidad de los pacientes.(2) El mecanismo subyacente no está claro; sin embargo, se presume que alteraciones inmunológicas podrían intervenir en la génesis de dicha manifestación, por la presencia de anticuerpos antigranulocitos o linfocitos sensibilizados con la ingesta del medicamento. Algunos estudios han identificado la edad y el sexo como factores de riesgo para el desarrollo de agranulocitosis, con mayor frecuencia en el sexo femenino y mayores de 50 años.(2,3)
Se ha identificado almetimazol, la sulfasalazina y trimetroprim-sulfametoxazol como desencadenantes potenciales de la agranulocitosis vinculada a fármacos.(4) No existe un método preciso para detectar pacientes que presenten alto riesgo de neutropenia inducida por fármacos. El seguimiento de la cuantificación de neutrófilos en pacientes que ingieren medicamentos que predispongan a alteraciones hematológicas de este tipo, debe realizarse periódicamente con el fin de permitir la detección temprana e intervención oportuna.(1,4) En un estudio realizado en Japón, se evaluó la eficacia del monitoreo de rutinaria del recuento de leucocitos en 15 398 pacientes con enfermedad de Graves que recibieron terapia con tionamidas durante un período de 12 años y se detectó un recuento absoluto de neutrófilos menor que 500 células/µL en 55 pacientes, el 0,4 % de la muestra, en su mayoría asintomáticos al momento del diagnóstico.(5)
En el presente estudio se reporta un caso de neutropenia febril vinculada a la ingesta de metimazol en una paciente atendida en una institución de salud en la ciudad de Barranquilla, Colombia, en el año 2017. A pesar que la incidencia de dicha complicación es baja, debe sospecharse en todo paciente que ingiera este tipo de medicamentos de forma regular y presente neutropenia, teniendo en cuenta la gravedad de las complicaciones relacionadas, por lo cual se debe realizar un seguimiento periódico del recuento de neutrófilos, para así facilitar la intervención oportuna.
PRESENTACIÓN DEL CASO
Paciente femenina, de 37 años de edad, raza mestiza, con antecedentes de hipertiroidismo primario, tratada con metimazol y propanolol durante las cuatro semanas previas al ingreso.
Fue consultada por un cuadro clínico de aproximadamente dos semanas de evolución, caracterizado por poliartralgias simétricas en manos, muñecas, codos, rodillas y tobillos; el dolor articular se incrementaba con la actividad física y cedía con el reposo, sin presencia de rigidez matutina; su intensidad aumentó de forma paulatina hasta tornarse incapacitante. Presentó erupción cutánea generalizada, con prurito moderado, úlceras en cavidad oral, hiporexia, disfagia y odinofagia. Una semana antes del inicio de los síntomas mencionados manifestó fiebre no cuantificada, de predominio nocturno y matutino, que cedía con antipiréticos automedicados (acetaminofén 1 000 mg por vía oral cada 6 horas) acompañada de astenia y adinamia.
Al examen físico de ingreso se evidenció fiebre de 39°C, marcha antálgica por dolor poliarticular, adenopatías cervicales múltiples, bilaterales de 2x2 cm, dolorosas, móviles, de consistencia cauchosa, sin la presencia de alteraciones estructurales ostensibles de la glándula tiroidea o datos de órbitopatía, articulaciones dolorosas sin sinovitis.
En los exámenes paraclínicos al ingreso se evidenció bicitopenia, conteo de leucocitos de 1 100 células/mm3 con recuento absoluto de neutrófilos de 9,9 células/mm3 y anemia microcítica normocrómica grave, de acuerdo a la clasificación de la Organización Mundial de la Salud (OMS).(6) (tabla 1)
Se inició tratamiento con antibiótico de amplio espectro: cefalosporina de cuarta generación (cefepime 2 g, por vía intravenosa cada 8 horas), en el contexto de una neutropenia febril de alto riesgo y antinflamatorio no esteroideo (acetaminofén 1 000 mg, vía oral cada 8 horas) para el manejo de las poliartralgias.
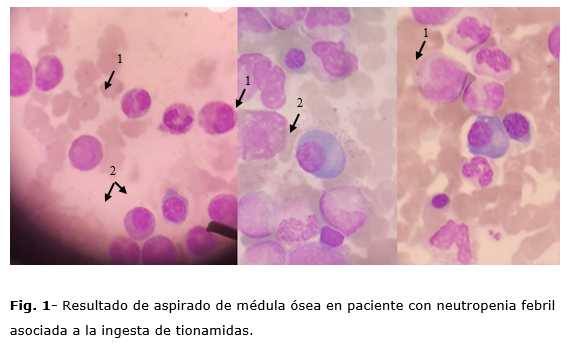
Una vez hecho el diagnóstico de neutropenia febril, fue suspendido el medicamento antitiroideo, con el posterior incremento paulatino del recuento de neutrófilos, hasta alcanzar 2 793 células/µL en el día 4 (tabla 1). La paciente fue valorada por el servicio de hematología, se realizó aspirado medular que se informó como una medula ósea reactiva, con cambios megaloblásticos discretos en eritroblastos, reacción plasmo celular y displasia de megacariocitos, los cuales pudieran estar relacionados a la enfermedad de base o la toxicidad o autoinmunidad generada por el fármaco antitiroideo (Fig. 1).
Se observa celularidad aumentada dada por: megacariocitos aumentados (1), la mayoría monolobulados; diferencial normal con aumento discreto de células plasmáticas 7 %, reactivas (2). (Aumento: 400x, Tinción: Hematoxilina-Eosina)
Luego de descartar al propranolol como agente causal, porque se le dio continuidad a su ingesta; además de otras causas como infecciones o neoplasias; se concluyó entonces que los síntomas y signos estaban relacionados con el uso del metimazol, el cual generó no solo efectos tóxicos (rash cutáneo, prurito generalizado y artralgias) sino que posiblemente actuó como hapteno, al generar que sus metabolitos se unieran a la superficie de los neutrófilos, causando la producción de autoanticuerpos que disminuyeron el recuento de estas células. Se planteó este diagnóstico y se tuvo en cuenta también la prueba terapéutica a la que fue sometida, basada en que posterior a la suspensión de la tionamida mejoró ostensiblemente el recuento de neutrófilos, además de la mejoría sintomática evidenciada.
DISCUSIÓN
La neutropenia febril por fármacos antitiroideos es poco frecuente en Colombia y el mecanismo por el cual se produce no es lo suficientemente claro; sin embargo, se postula que ocurre una reacción humoral autoinmune contra las células madre en la médula ósea. También se han realizado estudios genéticos en los que se ha podido determinar que los pacientes con enfermedad de Graves portadores del alelo HLA DRB1*08032 podrían presentar susceptibilidad para producir agranulocitosis por metimazol.(7,8) La mayoría de los efectos adversos asociados a las tionamidas son leves y transitorios.(9) Se ha documentado que aproximadamente el 5 % de los pacientes pueden presentar rash y prurito.(10) El efecto adverso más temido es la neutropenia de causa autoinmune, que se asocia con elevada mortalidad.(11) Durante el curso de este evento adverso, las infecciones pueden complicarse y dominar el cuadro clínico; las infecciones orofaríngeas son las más comunes y los pacientes generalmente presentan fiebre, odinofagia o disfagia,(12) tal como lo presentó la paciente objeto de estudio. En estos casos se debe emplear antibióticos de amplio espectro y retirar inmediatamente el medicamento antitiroideo. En la ciudad de Barranquilla (Colombia), existe un estudio como antecedente, en el que se determinó la seguridad del metimazol en el tratamiento del hipertiroidismo por enfermedad de Graves en menores de 18 años, en el que el 10 % de la población evaluada presentó leucopenia leve y respondieron adecuadamente a la suspensión o ajuste del medicamento sin otras complicaciones asociadas.(13)
En cuanto al tiempo de aparición de las complicaciones de neutropenia por tionamidas; la paciente estudiada presentó neutropenia 15 días después del inicio del tratamiento con metimazol; lo que coincide con lo reportado en la literatura en la que se describen casos de hasta tres meses posterior al inicio del tratamiento.(13) Por otra parte, el conteo de leucocitos se elevó a las 24 horas de suspendido el metimazol, tiempo más corto que lo descrito en la literatura, en la cual se refieren a un lapso entre una semana y dos meses posterior a la suspensión de la tionamida. En Latinoamérica se reportó el caso de una paciente que no elevó el recuento de leucocitos a pesar de la suspensión del medicamento y haber recibido siete días de tratamiento con factor estimulante de colonias.(14)
No hay evidencia concluyente de que la neutropenia inducida por medicamentos podría ser dosis dependiente; la mayoría de los estudios a nivel mundial revelan que con mayor frecuencia este evento se presenta en pacientes que reciben dosis iguales o mayores a 30 mg/d. Por el contrario, otros estudios han encontrado que la neutropenia inducida por tionamidas es independiente de la dosis, la edad, la duración del tratamiento o segunda exposición al medicamento.(15) En el caso clínico reportado en este estudio se observaron complicaciones independientes de la dosis, y se tuvo en cuenta que la dosis de metimazol suministrada a la paciente fue de 20 mg/d.
Los pacientes con Enfermedad de Graves ocasionalmente pueden cursar con neutropenia antes de iniciar el tratamiento con tionamidas, por la naturaleza impredecible e idiosincrática; por esta razón, la mayoría de expertos recomienda el monitoreo del hemograma.(16) Es importante educar al paciente acerca de esta complicación, y se le indica suspender el fármaco, si presenta fiebre y dolor de garganta. El pronóstico de la neutropenia inducida por medicamentos ha mejorado con los avances en la terapia de soporte, que incluye antibióticos, transfusiones sanguíneas y el uso de factor estimulante de colonias granulocíticas(GM-CSF).(17,18) La administración de factor estimulante podría reducir el tiempo de recuperación y la estancia hospitalaria, lo cual se observa en estudios realizados en Asia en donde se ha determinado que el tiempo de recuperación es de 5.5 a 9,2 días.(14,18) En el caso presentado en este estudio no fue necesario el suministro de GM-CSF, ya que a las 24 horas de suspendido el tratamiento e inicio de antibiótico de amplio espectro se obtuvo recuperación medular.
En conclusión, no existe un método específico para prever la aparición de neutropenia febril por metimazol; su instauración puede ser abrupta, en muchas ocasiones.(19-21) Con el reporte de este caso, se pretende resaltar la importancia de los controles periódicos en los pacientes con ingesta de tionamidas, que deben incluir de forma rutinaria el hemograma.(22) La neutropenia febril inducida por tionamidas es un diagnóstico de exclusión, su identificación temprana permitirá establecer intervenciones oportunas, ya que por lo general aunque tiene complicaciones graves por procesos infecciosos asociados, la recuperación en el conteo de neutrófilos es relativamente rápida posterior a la suspensión del medicamento.
REFERENCIAS BIBLIOGRÁFICAS
1. Vicente N, Cardoso L, Barros L, Carrilho F. Antithyroid Drug Induced Agranulocytosis: State of the Art on Diagnosis and Management. Drugs R D. 2017;17(1):91-6.doi: 10.1007/s40268-017-0172-1.
2. He Y, Li J, Zheng J, Khan Z, Quiang W, Gao F, et al. Emphasis on the early diagnosis of antithyroid drug induced agranulocytosis: retrospective analysis over 16 years at one Chinese center. J Endocrinol Invest. 2017;40(7):733-40. doi: 10.1007/s40618-017-0626-x.
3. León Morales F, Mateos Toledo H, Caballero Caballero R. Agranulocitosis con plasmocitosis reactiva atípica inducida por metimazol en una paciente con hipertirodismo. Med Int Méx. 2008;24(5):357-60.
4. Andre`s E , Mourot-Cottet R , Maloisel F , Se´verac F , Keller O, Vogel T, et al. Idiosyncratic drug-induced neutropenia and agranulocytosis. QJM. 2017 Jan 9. pii: hcw220. doi: 10.1093/qjmed/hcw220.
5. Bukhari S, Khan M, Kumar N, Mohan V. Increased risk for thionamide-induced agranulocytosis in elderly patients: a case presentation and literature review. BMJ Case Rep. 2017 Jul 17;2017. pii: bcr-2017-220924. doi: 10.1136/bcr-2017-220924.
6. WHO/NMH/NHD/MNM/11.1. Concentraciones de hemoglobina para diagnosticar la anemia y evaluar su gravedad [ Internet] . 2011. [ Citado: 02/08/2017] . Disponible en: http://www.who.int/vmnis/indicators/haemoglobin_es.pdf .
7. Mark Edy P, Enciso L. Presentación de caso clínico: toxicidad hematológica en una paciente hipertiroidea tratada con metimazol. Acta Med Colomb.2008. (Supl 1):82. [ Citado: 02/08/17] . Disponible en: http://www.actamedicacolombiana.com/anexo/articulos/03S-2008-08.pdf .
8. Watanabe N, Narimatsu H, Noh JY, Yamaguchi T, Kobayashi K, Kami M, et al. Antithyroid drug induced hematopoietic damage: a retrospective cohort study of agranulocytosis and pancytopenia involving 50.385 patients with Graves' disease. J. Clin Endocrinol Metab. 2012;97(1):49-53. doi: 10.1210/jc.2011-2221.
9. Ross DS, Burch HB, Cooper DS. American Thyroid association pautas para el diagnóstico y tratamiento del hipertiroidismo y otras causas de tirotoxicosis. Thyroid 2016; 26(1): 231-72.
10. Franklyn J. Thyroid gland: Antithyroid therapy best choice of drug and dose. Nature Rev Endocrinol. 2009;5(11):592-4.doi: 10.1038/nrendo.2009.201
11. Maciel ME, Duranona KB. Agranulocitosis adquirida: planteos diagnósticos. Hematología. 2016;20(1):115-8.
12. Cooper D. Antithyroid Drugs. New Engl J Med. 2005;352:905-17. doi: 10.1056/NEJMra042972
13. Alvira J, Galván G, Ordoñez J, Parga C. Eficacia y seguridad del metimazol en el tratamiento del hipertiroidismo por enfermedad de Graves en menores de 18 años. Barranquilla, 2013-2015. Biociencias. 2016;11(1):41-7.
14. Manrique-Hurtado H, Pinto-Valdivia M. Agranulocitosis inducida por metimazol en una paciente con enfermedad de Graves. Rev Med Hered. 2013; 24:109-13.
15. T ajiri J, Noguchi S. Antithyroid drug induced agranulocytosis: how has granulocyte colonystimulating factor changed therapy? Thyroid. 2005;15(3):292-7. doi: 10.1089/thy.2005.15.292
16. Mourot-Cottet R, Maloisel F, Séverac F, Keller O, Vogel T, Tebacher M, et al. Idiosyncratic Drug-Induced Severe Neutropenia and Agranulocytosis in Elderly Patients (³75 years): A Monocentric Cohort Study of 61 Cases. Drugs Real World Outcomes. 2016 Dec;3(4):393-9.
17. Kim H, Lee J, Ha J. A case of antithyroid drug-induced agranulocytosis from a second antithyroid drugs (ATD) administration in a relapsed Graves' disease patient who was tolerant to the first ATD treatment. Clin Case Rep. 2018 Jul 10;6(9):1701-1703. doi: 10.1002/ccr3.1644
18. Pick AM, Nystrom KK. Non chemotherapy Drug-Induced Neutropenia and Agranulocytosis: could medications be culprit? J. Pharm. Pract. 2014; 27(5):447-52.doi: 10.1177/0897190014546115.
19. Johnston A, Uetrecht J. Current understanding of the mechanism of idiosyncratic drug induced agranulocytosis. Expert Opin Drug Metab Toxicol 2015;11:243-257.doi: 10.1517/17425255.2015.985649.
20. Varışlı B, Yıldırım S, Karaçam H, Paker Ş. Methimazole-induced febrile neutropenia. J Emerg Med Case Rep. 2018; 9: 13-5. doi: 10.5152/jemcr.2018.1851
21. Klastersky J, De Naurois J, Rolston K, Rapoport B, Maschmeyer G, Aapro M, et al. Management of febril neutropaenia: ESMO Clinical Practice Guidelines. Ann Oncol. 2016; 27(suppl 5): v111-v8. doi: 10.1093/annonc/mdw325
22. Yang J, Zhong J, Xiao XH, Zhou LZ, Chen YJ, Liu JH, et al. The relationship between bone marrow characteristics and the clinical prognosis of antithyroid drug induced agranulocytosis. Endocr J. 2013;60(2):185-9.